基于超分子组装的可编程纳米药物作为原位疫苗激活抗肿瘤免疫响应
充分高效的免疫激活是免疫治疗发挥抗肿瘤作用的关键。通过材料设计提升免疫激活效率是一种非常有效的手段,近年来也得到了大量的研究。然而,肿瘤的免疫激活过程是一个从抗原释放、抗原捕获、树突细胞活化、抗原呈递到效应细胞产生的多步过程,不同步骤之间对材料性质的要求各不相同,使用结构简单的单一纳米粒子同时满足复杂的免疫激活过程的所有要求存在很多矛盾和障碍。超分子组装可以利用简单的模块构筑复杂的结构,特别适合用于制备具有复杂功能的纳米结构以满足肿瘤免疫治疗过程中对材料的多功能需求。
近日,中国科学院长春应用化学研究所陈学思院士(点击查看介绍)和宋万通副研究员(点击查看介绍)团队基于上述思考,创新性提出了利用超分子组装构建可编程免疫激活纳米药物(Programmable Immune Activation Nanomedicine,PIAN)来克服免疫激活过程中多步障碍。该可编程纳米药物PIAN是由接枝β-环糊精和四价铂前药的聚(N-2-羟乙基)-L-天冬酰胺(PPCD)通过β-环糊精和金刚烷的超分子作用与负载CpG佐剂的阳离子超支化聚合物(CpG/PAMAM-TK-Ad)和聚乙二醇(mPEG-TK-Ad)共组装得到。PIAN静脉注射后在肿瘤部位积聚,肿瘤微环境中的高活性氧(ROS)水平会引起PIAN解离,释放PPCD和正电性的小粒子CpG/PAMAM。PPCD造成肿瘤细胞杀伤和抗原释放;CpG/PAMAM可以捕获并携载肿瘤抗原回流到肿瘤引流淋巴结,促进肿瘤抗原内化进入树突状细胞(DC细胞),增强DC细胞活化,并随后刺激免疫效应细胞产生(图1)。
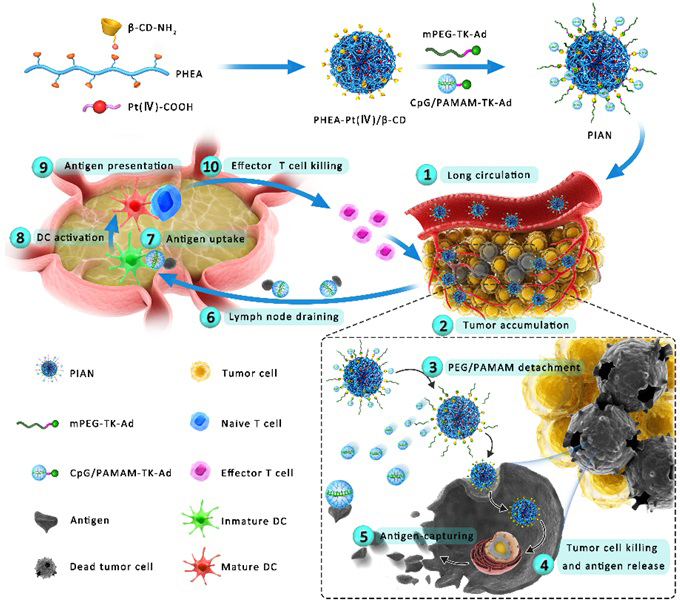
图1. PIAN的制备过程及其激活抗肿瘤免疫响应的作用机制图。
团队首先利用动态光散射确定PPCD与mPEG-TK-Ad和CpG/PAMAM-TK-Ad共组装比例为2:8:1时,PIAN的组装结构最稳定,该组装比例下PIAN的尺寸约为220 nm。透射电镜结果显示PIAN呈草莓状结构,表明CpG/PAMAM-TK-Ad成功挂载到PPCD的表面;更为重要的是PIAN在ROS作用下会释放出PPCD和较小尺寸的CpG/PAMAM,表明PIAN的组装结构可以实现高ROS条件下的解体(图2)。

图2. PIAN的组装行为研究。a:动态光散射测定不同浓度过氧化氢处理后PIAN的粒径随时间的变化;b:PIAN(左)和PIAN在25 ℃ 条件下0.1 mM 过氧化氢溶液中孵育24小时后(右)的形貌。
体外实验表明,PIAN的内核PPCD对肿瘤细胞具有杀伤作用,并且这种杀伤作用呈现剂量依赖性(图3a-b)。PIAN挂载的PAMAM则会增强模型抗原(卵清蛋白,OVA)被BMDC细胞的摄取(图3c)。不仅如此,PAMAM与CT26肿瘤细胞裂解液和免疫激动剂CpG的复合物会显著地增强BMDC细胞的活化和促炎型细胞因子的分泌(图3d-e)。
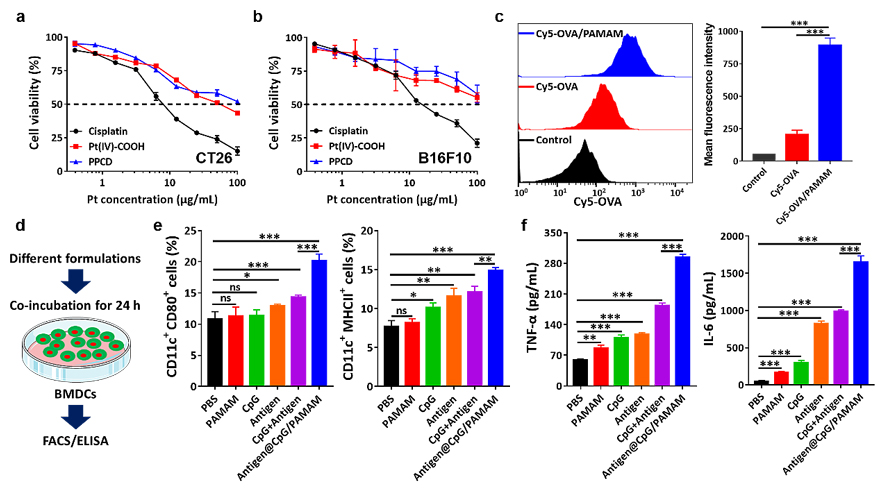
图3. 体外评价PIAN各组分的功能。顺铂、四价铂前药和PPCD对CT26细胞(a)和B16F10细胞(b)的细胞毒性;c:BMDC对OVA和OVA/PAMAM复合物的摄取;d: 体外BMDC活化实验步骤示意图;e:不同条件下,BMDC活化的结果;f:不同条件下,BMDC分泌细胞因子的结果。
在体内实验中,团队分别使用荧光标记的PPCD和荧光标记的CpG/PAMAM-TK-Ad构建了两种PIAN—PIAN-C/Cy5和PIAN-P/Cy5(图4a-b)。荷瘤小鼠静脉接受PIAN-C/Cy5 4小时后,肿瘤组织可以明显地观察到PPCD的荧光,在静脉注射24小时后,肿瘤组织中的PPCD荧光强度相比于4小时并没有明显改变(图4c);但是在肿瘤引流淋巴结中几乎观察不到PPCD的荧光,这是由于PIAN在肿瘤组织中释放的较大尺寸的PPCD倾向长时间停留在肿瘤组织(图4d-e)。相比之下,荷瘤小鼠静脉接受PIAN-P/Cy5时,肿瘤引流淋巴结可以观察到很强的CpG/PAMAM的荧光(图4f)。对淋巴结切片染色分析发现,CpG/PAMAM(红色)均匀的分布在淋巴结中,并且可以观察到CpG/PAMAM与DC细胞(绿色)共定位(白色),表明在体内CpG/PAMAM可以从PIAN中释放出来,到达肿瘤引流淋巴结并接触到DC细胞(图4g)。
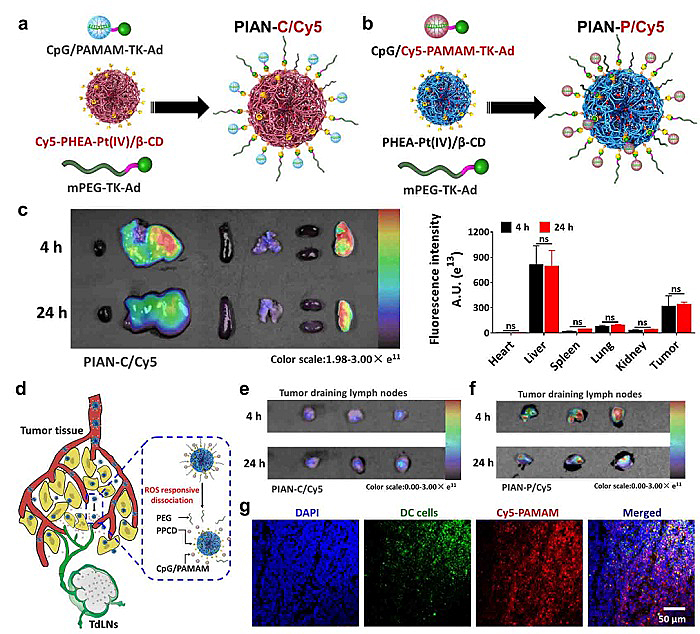
图4. PIAN实现PPCD在肿瘤组织中的蓄积和CpG/PAMAM回流到肿瘤引流淋巴结。a:PIAN-C/Cy5的构建;b:PIAN-P/Cy5的构建;c:CT26荷瘤小鼠静脉接受 PIAN-C/Cy5后,4和24小时肿瘤和主要器官的离体荧光图像和定量分析结果;d:PIAN在肿瘤组织中解离及肿瘤引流淋巴结回流示意图;e: CT26荷瘤小鼠静脉接受PIAN-C/Cy5后,4和24小时肿瘤引流淋巴结的离体荧光图像;f:CT26荷瘤小鼠静脉接受PIAN-P/Cy5后,4和24小时肿瘤引流淋巴结的离体荧光图像;g:CT26荷瘤小鼠静脉接受PIAN-P/Cy5 24小时后,小鼠肿瘤引流淋巴结免疫荧光染色结果,蓝色:细胞核,绿色:DC细胞,红色:CpG/PAMAM。
团队进一步在B16F10和CT26皮下肿瘤模型上评价了PIAN的治疗效果。结果显示,在这两种小鼠肿瘤模型上单独使用PIAN治疗都显著地抑制了小鼠肿瘤的生长(图5a-b)。对治疗后的小鼠肿瘤引流淋巴结和肿瘤组织分析发现,PIAN治疗组的小鼠肿瘤引流淋巴结内DC细胞大量活化,并且肿瘤组织中的CD4+和CD8+ T细胞的比例大幅增加,表明PIAN的治疗可以提升免疫激活效率,从而发挥原位肿瘤疫苗的作用(图5c-d)。
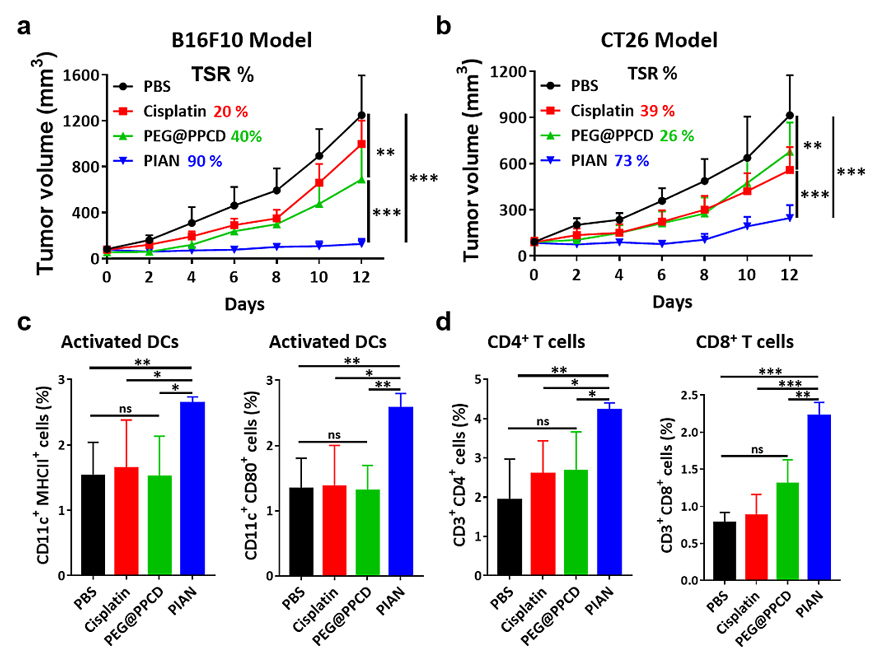
图5. PIAN的体内抗肿瘤结果和免疫激活效应评价。不同药物治疗后,B16F10荷瘤小鼠(a)和CT26荷瘤小鼠(b)的肿瘤生长体积曲线;不同药物治疗后,CT26荷瘤小鼠的肿瘤引流淋巴结内DC细胞的活化比例(c)及肿瘤组织中浸润的T细胞的比例(d)。
PIAN通过免疫激活引起的肿瘤内T细胞浸润增加为αPD-L1抗体的应用提供了基础,在进一步的研究中,PIAN联合αPD-L1抗体治愈了40 %的结肠癌荷瘤小鼠,延长了小鼠的生存期(图6)。

图6. PIAN联合αPD-L1抗体的肿瘤治疗结果。a:PIAN联合PD-L1抗体的治疗方案;b:不同治疗组的小鼠肿瘤生长曲线;c:各治疗组中单只小鼠的肿瘤生长曲线;d: 不同治疗组的小鼠体重变化曲线;e:不同治疗组的小鼠生存曲线。
综上,该研究提出利用超分子组装制备可编程纳米药物用于抗肿瘤免疫治疗和原位肿瘤疫苗设计,为解决肿瘤免疫激活过程中的多步障碍提供了新的研究思路。相关结果发表在Advanced Materials 上。文章的第一作者是中国科学院长春应用化学研究所助理研究员张瑜博士和特别研究助理马胜博士。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Supramolecular Assembled Programmable Nanomedicine As In Situ Cancer Vaccine for Cancer Immunotherapy
Yu Zhang, Sheng Ma, Xinming Liu, Yudi Xu, Jiayu Zhao, Xinghui Si, Hongxiang Li, Zichao Huang, Zhenxin Wang, Zhaohui Tang, Wantong Song*, Xuesi Chen*
Adv. Mater., 2021, DOI: 10.1002/adma.202007293
通讯作者介绍

陈学思,中国科学院院士,中国科学院长春应用化学研究所研究员,学术委员会副主任,中国科学院生态环境高分子材料重点实验室学术委员会副主任。2004年以来分别获国家杰出青年科学基金、国务院政府特殊、吉林省高级专家、长春市特等劳动模范,2013年入选科技部科技创新创业人才和万人计划。2016年入选国际生物材料与工程联合会会士。任学术期刊《ACS Biomaterials Science and Engineering》副主编,任《Advanced Healthcare Materials》,《Advanced Theraputics》,《Journal of Controlled Release》等编委或顾问编委。目前主要从事生物降解医用高分子材料、组织工程和药物缓释、聚乳酸和聚ɛ-己内酯产业化等方向的研究与开发工作。作为项目负责人承担科技部国家“十三五”重点研发计划项目,国家自然科学基金基础科学研究中心项目等。
同浙江海正集团合作实现了1.5万吨聚乳酸产业化,技术水平达到了国际领先。组建了长春圣博玛生物材料有限公司,获得了可吸收骨折内固定钉和板CFDA两个注册证(III类),3个产品已提交注册申请或在临床评价(III类)。发表SCI学术论文800余篇,SCI他引3.0万余次,h-指数为89。授权专利280余项。获赢创化学创新奖,中国科学院科技促进发展奖和科技贡献奖,第六届侯德榜化工科学技术奖,中国石油和化学工业联合会技术发明奖,吉林省科技进步奖一等奖2项。
https://www.x-mol.com/university/faculty/15824

宋万通,中国科学院长春应用化学研究所副研究员。2008年本科毕业于南京大学,2013年在中国科学院大学获得博士学位(导师:陈学思院士),之后留所工作;2016年到2018年赴美国北卡罗来纳大学教堂山分校药学院进行博士后研究(导师:Leaf Huang教授)。目前主要从事免疫治疗与高分子材料交叉方向的研究工作,以第一/通讯作者在Nature Nanotechnology, Nature Communications, Advanced Materials, Advanced Functional Materials, ACS Nano, Nano Letters, Biomaterials等杂志发表研究及综述论文60余篇。获得2018年度美中抗癌协会&亚洲癌症研究基金会青年学者奖,2019年度中美纳米医学与纳米生物技术学会未来之星奖,担任中国生物医学工程学会纳米医学与工程分会青年委员,2019年入选中国科学院青年创新促进会。
https://www.x-mol.com/university/faculty/281096
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:以免疫检查点抑制剂为代表的免疫治疗的成功为癌症患者带来了治愈的希望。但仍要清醒地认识到目前免疫治疗依旧面临治疗响应率低的问题,在一些肿瘤类型上的响应率低于20 %。患者的免疫激活不足是造成的这一结果的主要原因之一。然而,肿瘤的免疫激活过程是一个复杂的多步过程,只有同时实现免疫激活的各个步骤才可以获得高效的免疫激活。但是免疫激活的不同步骤对材料性质的要求各不相同且彼此矛盾,这为设计有效实现免疫激活的材料提出了更高的要求。超分子组装可以利用简单的模块构筑复杂的结构,可以通过简单的组装获得具有多种功能的复杂纳米结构。因此我们利用超分子组装设计了一种可编程的纳米药物,实现肿瘤杀伤获取肿瘤抗原并可以将抗原及佐剂递送到淋巴结,激活特异性抗肿瘤免疫响应。
Q:研究过程中遇到哪些挑战?
A:研究过程的挑战主要包括两个:一是设计合适的共组装元件满足体内递送及免疫激活多步过程的需求。体内递送及免疫激活不同步骤对材料的功能和特性的要求存在矛盾,利用简单的共组装方法构建多功能的复杂纳米结构是解决这一矛盾最合适的方法;二是解决可编程纳米药物的体内循环稳定和肿瘤组织特异性解体之间的矛盾,纳米药物需要在静脉注射后的体内循环过程中保持结构稳定,而到达肿瘤组织后可以释放出具有不同功能的组分,完成后续免疫激活过程。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助?
A:该研究设计的可编程纳米药物具有制备简单,功能多样,可扩展性强的特征,对于原位个性化肿瘤疫苗制备具有重要意义。如果能够推广到临床,则能够有效地解决肿瘤疫苗所面临的特异性抗原获取困难、佐剂和抗原共递送和获得性免疫激活的难题。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号