李祥/李海涛组合作开发AF9 YEATS结构域首个高选择性环肽抑制剂
组蛋白翻译后修饰是调控表观遗传学事件的重要机制之一,通常其受到“书写器”(“Writer”)和“擦除器”(“Eraser”)的严密调节,并且通过招募“阅读器”(“Reader”)效应蛋白来控制染色质结构及相关基因表达,从而影响DNA复制、细胞分裂、分化和凋亡等关键的细胞进程。越来越多证据表明,组蛋白修饰水平的失调以及识别的紊乱可能是一些人类疾病(如癌症)的重要发病原因之一,这也使得组蛋白修饰相关蛋白成为近年来表观遗传学药物研发的热门靶点之一。
YEATS结构域是2014年由清华大学李海涛课题组和美国MD安德森癌症中心石晓冰实验室鉴定出的新型组蛋白乙酰化“阅读器” [1],近年来又被发现可以更强的亲和力识别组蛋白巴豆酰化(Kcr)并调控相关基因表达 [2-5]。人类基因组共编码4种含有YEATS结构域的蛋白,分别是ENL、AF9、YEATS2和GAS41,其中ENL和AF9的YEATS结构域具有很高的序列相似性[6]。
此前,香港大学化学系李祥(点击查看介绍)课题组和清华大学医学院李海涛(点击查看介绍)团队曾于2018年在Nature Chemical Biology 上首次报导了一类靶向AF9和ENL YEATS结构域的高效、特异性抑制剂 [7],其中两个最高效的五肽抑制剂XL-07i和XL-13a的活性达到了亚微摩尔级别(IC50分别为AF9:0.26 μM和0.24 μM;ENL:1.30 μM和0.71 μM)。但是由于AF9和ENL的YEATS结构域非常相似,两款五肽抑制剂只表现出3-5倍的选择性,而AF9和ENL在后续的基因调控活动中又发挥着不同的作用 [8],为此亟需开发一款具有高选择性的抑制剂以表征这两种蛋白在后续调控活动中扮演的不同角色。
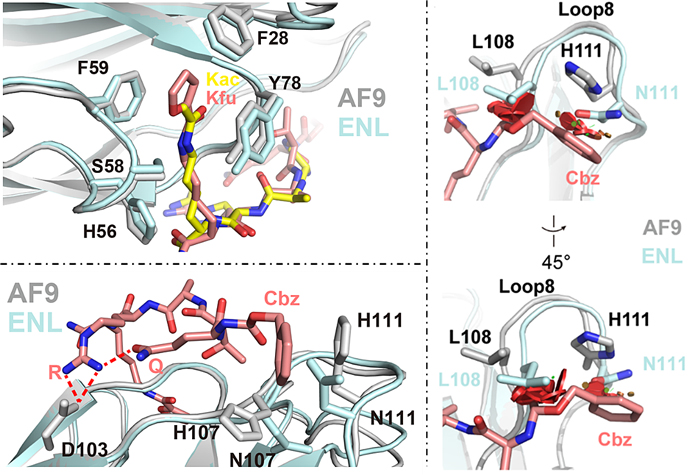
图1. AF9与ENL 结构比较
在此基础之上,李祥课题组通过仔细对比AF9 YEATS结构域与五肽抑制剂XL-07i复合物的晶体结构和ENL YEATS结构域与组蛋白H3K27cr多肽复合物的晶体结构,发现AF9和ENL YEATS结构域虽然在赖氨酸酰基结合口袋处具有很高的结构一致性,但是在Loop 8区域上表现出了一定的不同特性。与AF9相比,Loop 8在ENL中会形成更多的分子内氢键,导致整个结构具有更大的刚性,从而不易接受外来的配体分子。此外五肽抑制剂中的Cbz基团会与AF9 Loop 8中的两个组氨酸形成π堆积结构从而增强相互作用,而相对应的位置在ENL中则是两个天冬酰胺并没有发现π堆积结构的存在。这些结构上的发现预示着Loop 8区域将会是实现抑制剂高选择性的关键点。
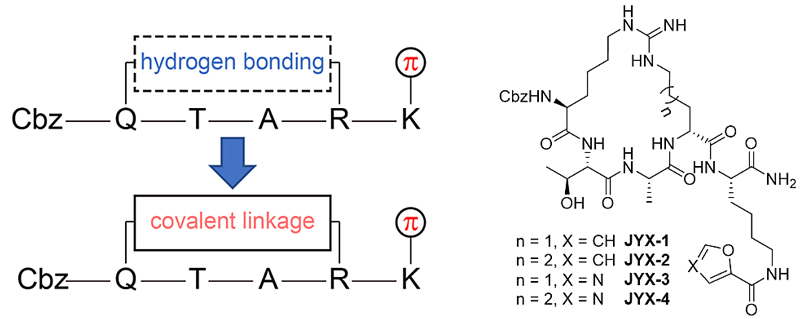
图2. 环肽抑制剂的设计策略以及相应结构
值得注意的是,在AF9 YEATS与XL-07i复合物的晶体结构中,为了形成更好的相互作用,XL-07i采取了一种扭曲的构象用以在相邻的精氨酸以及谷氨酰胺末端形成一个分子内氢键。由此,作者大胆推测若是用共价键取代分子内氢键以形成一个环肽分子,将会形成一个受蛋白结合偏好的提前稳定的构象,为此作者根据此结构特征设计并合成出了一系列环肽抑制剂,并利用自己开发的一种竞争性光交联实验方法对这些环肽进行检测,其中活性最好的JYX-3表现出了0.41 μM的活性,虽然与此前的线状抑制剂相比活性略有下降,但是其选择性则是高达38倍之多。
为了进一步阐述环肽抑制剂高选择性的分子机理,作者首先做了相应的SAR研究,通过采用不同的基团取代原有Cbz基团,设计合成出了一系列环肽抑制剂类似物,最终发现Cbz基团仍然是最佳结构。为了进步一阐述Cbz对抑制剂选择性的贡献,作者又相继对AF9和ENL YEATS结构域进行了突变,获得了相对应的双突变体AF9NN和ENLHH。活性结果表明,其选择性竟然相应地实现了反转,由原先的38倍选择性变成了0.25倍。无论是SAR还是蛋白突变体的研究都进一步阐述了Cbz基团与组氨酸形成的π堆积结构对环肽抑制剂选择性的决定作用。
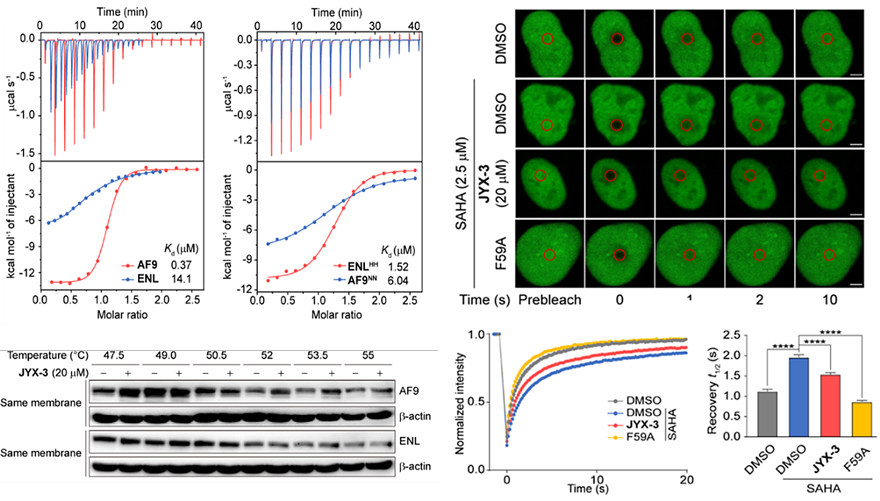
图3. JYX-3对AF9的高选择性以及细胞层面的作用
接下来作者对JYX-3开展了细胞层面的活性研究。首先作者利用IAM和PAMPA技术表征了JYX-3的细胞通透性,同时开展相关的稳定性探究,结果表明通过环化之后,与线状抑制剂相比环肽抑制剂确实可以提高相应的细胞通透性以及稳定性。作者又相继进行了在细胞核提取物中的下拉实验,研究表明JYX-3在内源性蛋白水平层面上具备有良好的活性以及选择性。而随后的在活细胞内热稳定性迁移实验(Cellular Thermal Shift Assay,CETSA)中,进一步揭示了JYX-3可以透过细胞膜,并特异性地靶向细胞内源的AF9而不会作用于内源的ENL蛋白。此外,作者又利用荧光漂白恢复技术(Fluorescence Recovery after Photobleaching,FRAP)证明了JYX-3能有有效阻止AF9与染色质的结合,而相应地对ENL却没有明显作用,进一步验证了其在细胞层面上的选择性。更重要的是,ChIP-qPCR和RT-PCR实验表明在HeLa细胞系中,JYX-3处理会阻碍AF9和其靶基因(MYC和PABPC1)的结合并显著性降低这些致癌基因的表达。
该论文是首个针对AF9 YEATS结构域具备高达38倍选择性的环肽抑制剂的报道,同时进一步阐述了环肽抑制剂高选择性的分子机理,所发现的Cbz-组氨酸形成的π堆积结构为今后对YEATS结构域或其他保守结构域的高选择性抑制剂的开发提供了新的思路。
此项研究近期发表于J. Am. Chem. Soc.,李祥组博士研究生姜益翔、李海涛组研究助理陈国超以及李祥组李晓萌博士为共同第一作者,李祥教授和李海涛教授以及各自课题组的李歆博士和李元元博士为共同通讯作者。
香港大学化学系李祥实验室长期致力于开发新颖化学方法以探究表观遗传学领域的相关问题,重点关注在解析组蛋白修饰的调节机制和它们的生物学意义。课题组擅长开发化学工具,并综合运用蛋白质组学、生物化学、细胞生物学、生物物理学等多种手段开展研究。近年的工作重点主要包括:1)开发光亲和性探针(photoaffinity probe)寻找新型组蛋白修饰的调控酶和效应蛋白;2)表征新型组蛋白修饰对核小体及染色体动态结构的影响;3)靶向组蛋白修饰相关蛋白化学探针的开发。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Selective Targeting of AF9 YEATS Domain by Cyclopeptide Inhibitors with Preorganized Conformation
Yixiang Jiang, Guochao Chen, Xiao-Meng Li, Sha Liu, Gaofei Tian, Yuanyuan Li*, Xin Li*, Haitao Li*, Xiang David Li*
J. Am. Chem. Soc., 2020, DOI: 10.1021/jacs.0c10324
导师介绍
李祥
https://www.x-mol.com/university/faculty/67624
李海涛
https://www.x-mol.com/university/faculty/44741
参考文献
1. Li, Y. et al. AF9 YEATS domain links histone acetylation to DOT1L-mediated H3K79 methylation. Cell, 159, 558–571 (2014).
2. Li, Y. et al. Molecular coupling of histone crotonylation and active transcription by AF9 YEATS domain. Mol. Cell, 62, 181–193 (2016).
3. Andrews, F. H. et al. The Taf14 YEATS domain is a reader of histone crotonylation. Nat. Chem. Biol., 12, 396–398 (2016).
4. Zhao, D. et al. YEATS2 is a selective histone crotonylation reader. Cell Res., 26, 629–632 (2016).
5. Zhang, Q. et al. Structural insights into histone crotonyl-lysine recognition by the AF9 YEATS domain. Structure, 24, 1606–1612 (2016).
6. Schulze, J. M., Wang, A. Y. & Kobor, M. S. YEATS domain proteins: a diverse family with many links to chromatin modification and transcription. Biochem. Cell. Biol., 87, 65–75 (2009).
7. Li, X. et al. Structure-guided development of YEATS domain inhibitors by targeting π-π-π stacking. Nat. Chem. Biol., 14, 1140–1149 (2018).
8. He, N. H. et al. Human Polymerase-Associated Factor com-plex (PAFc) connects the Super Elongation Complex (SEC) to RNA polymerase II on chromatin. P Natl Acad Sci, 108, E636–E645 (2011).
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


























 京公网安备 11010802027423号
京公网安备 11010802027423号