Nat. Commun.:碳碳双键的邻位双官能团化
1,2-乙二胺结构广泛存在于天然产物、药物分子、手性配体以及各类螯合配体中,例如肽类抗生素(图1a)、止咳药盐酸普鲁米嗪(Promethazine,图1b)、肺癌靶向药奥西替尼(Osimertinib)等。因此有关1,2-乙二胺(即邻位双胺)的合成就显得尤为重要。毫无疑问,直接通过亲核的胺试剂对碳碳双键进行加成是获得邻位双胺的最直接方法(图1c)。目前,也的确有不少关于胺对碳碳双键加成的报道,如金属催化(J. Am. Chem. Soc., 2018, 140, 135–138)、有机硒催化(J. Am. Chem. Soc., 2019, 141, 19161–19170)和光催化(Chem. Commun., 2019, 55, 2833–2836)等。总体上来说,烯烃的双胺化反应通常需要自由基或氧化条件,而烷基胺和芳基胺通常具有较强的还原性,因此这类反应仅限于几类特定的底物。尽管烯基硫正离子可以与α-氨基酮反应生成N,N-或N,O-杂环化合物(Org. Lett., 2012, 14, 6370–6373),但是目前仍没有报道过无金属催化的含氮亲核试剂进行的烯烃分子间双胺化反应。此外,不同含氮亲核试剂的区域选择性也是这类反应要面临的主要挑战。
考虑到三氟甲基化的烷基胺单元广泛存在于候选药物中,如治疗镰状细胞病(SCD)的Olinciguat、骨质疏松症药Odanacatib等(图1d),匈牙利罗兰大学的Zoltán Novák教授课题组尝试发展一种通用的氟代烯烃的分子间双官能化策略。近日,他们巧妙地利用三氟乙烯基碘正离子作为底物,实现了碳碳双键的邻位双胺化反应(图1f),有效地制备一系列三氟甲基化的乙基胺和乙二胺。相关成果发表在Nature Communications 上。
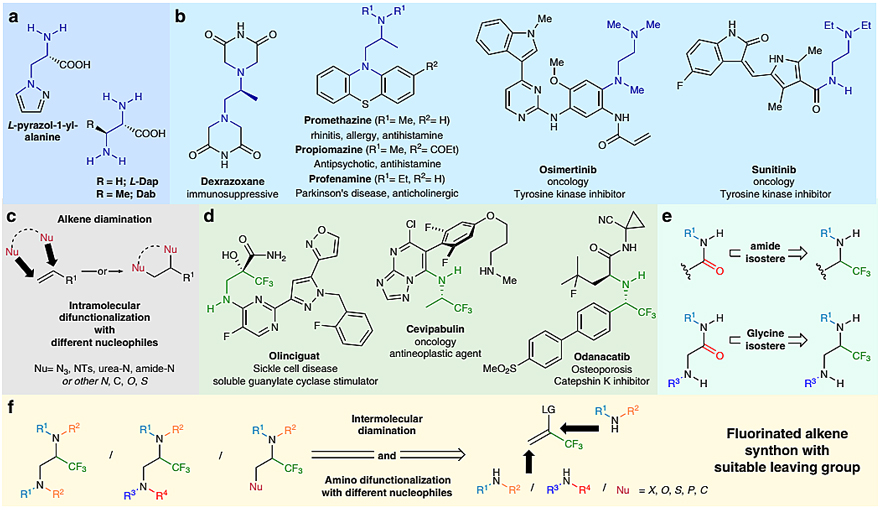
图1. 分子间双胺化反应。图片来源:Nat. Commun.
要想实现邻位双胺化,就必须选择一个有效的离去基团(图1f)。由于高价碘鎓盐具有较强的离去能力,并且高价碘的吸电子性可以增强烯基的亲电性,因此作者选择三氟乙烯基碘鎓盐1作为反应的底物。根据电性特征,仲胺亲核试剂会首先进攻烯基末端的碳原子,形成一个稳定的碘鎓叶立德中间体(图2b)。在质子转移后,此时的碘鎓盐中间体既能够直接与另一分子胺反应得到最终产物(图2b,Route A),也可以进行分子内亲核反应得到氮丙啶盐(图2b,Route B),后者开环得到目标产物。
首先,作者选择N-甲基-1-萘甲胺(1 equiv)为亲核试剂,在Na2CO3的作用下于25℃下进行反应,以12%的分离收率得到双官能团化的二胺产物。对胺、无机碱、溶剂进行筛选后,最终在conditions I下以90%的收率得到目标产物2(图2a)。为了证明该反应的机理,作者投入4当量胺进行反应,并用19F-NMR来监测反应,结果显示反应在15s内就完全转化,且只产生双胺化产物;相反,使用1当量的胺可能会产生氮丙啶盐中间体的非对映混合物。为了证明该中间体的存在,作者将氮杂环丙烷6与甲基化试剂MeOTf在d3-MeCN中于25℃下进行反应,原位制备了氮丙啶盐,其19F-NMR信号峰与1当量仲胺反应产物的信号相匹配,从而证明了它确实是反应的关键中间体。接下来,作者将获得的中间体X(由氮杂环丙烷6生成)与4当量仲胺进行反应,成功地得到了邻位双胺化产物,进一步证实了该反应确实经历氮丙啶盐中间体。

图2. 机理研究。图片来源:Nat. Commun.
然而,如果只能靠过量的胺进行同双胺化反应,那么该反应的适用范围将受到极大的限制。为此,作者尝试通过控制加入胺的顺序来实现邻位异双胺化,这就涉及到反应的区域选择性:究竟使用哪种氮原子亲核试剂?它又会进攻什么位置呢?由于氮丙啶盐的三氟甲基具有吸电子性,因此可以降低亲核取代开环的活化能。事实上,氮原子更倾向于进攻C-3位进行开环反应,因为C-3属于二级碳,位阻小,动力学上较为有利。不过为了避免同双胺化,形成氮丙啶盐的胺必须严格按照1.00当量加入。在此基础上,作者对反应时间、浓度、温度等进行了优化,最终在conditions II下以76%的收率得到目标产物3。
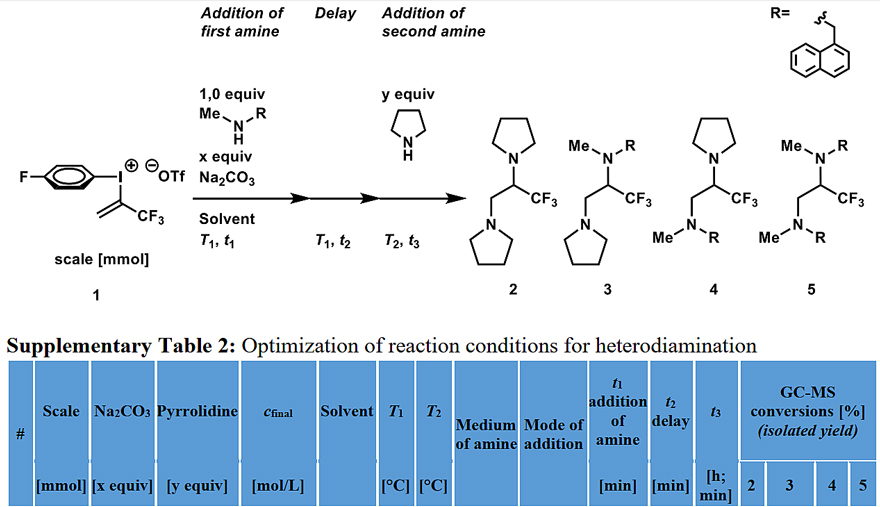

图3. 邻位异双胺化条件优化。图片来源:Nat. Commun.
在最优条件下,作者对同双胺化反应的底物范围进行了考察(图4)。首先,作者考察了二级芳香胺,最简单的N-Me苯胺以76%的收率得到二胺产物(7),而N-Et苯胺的效果则较差,收率仅13%。N-Et-苯胺的环状类似物吲哚啉和四氢喹啉,分别以93%和50%的收率得到相应的二胺9和10。此外,作者考察了苯胺环上取代基的电子效应和空间效应,结果显示邻位只有甲氧基取代的苯胺能实现双胺化(收率:44%);间位和对位取代(如Me、F、Cl、Br等)的苯胺均具有良好的耐受性,以39-78%的收率得到所需的产物(12–18);而吸电子基团(如COOMe、CF3、NO2)取代的苯胺则无法实现这一转化。其次,作者考察了脂肪族仲胺,二异丁胺(20)、二苄基胺(21)、亚氨基二乙酸二甲酯(22)、对甲氧基苄基(PMB)取代的胺(23-27)以及炔丙胺衍生物(28-31)都能兼容该反应,特别是亚氨基二乙酸二甲酯几乎定量地得到了二胺。最后,作者考察了四至七元饱和环胺,以中等至较好的收率(51-89%)得到目标产物(33-43)。
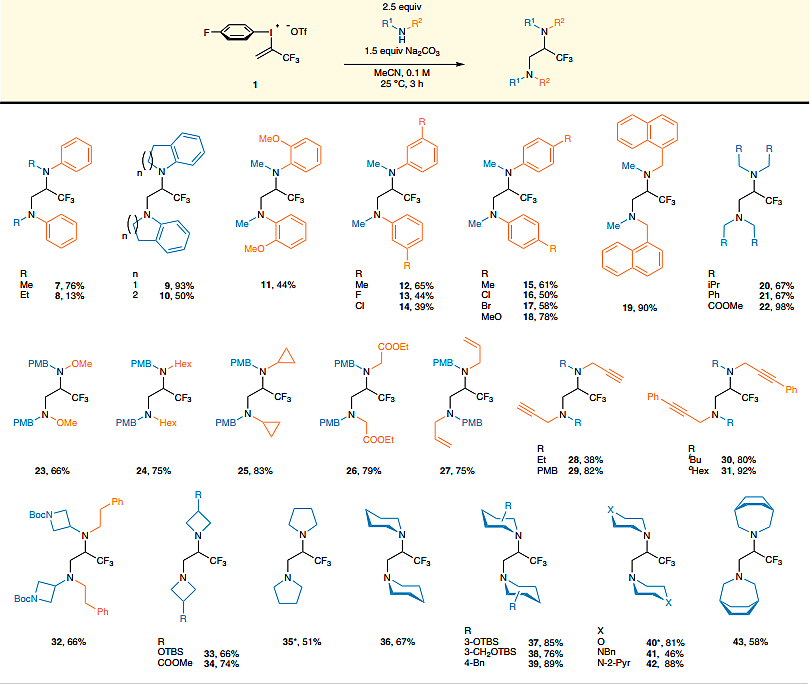
图4. 底物拓展-邻位同双胺化。图片来源:Nat. Commun.
随后,作者考察了邻位异双胺化的底物范围(图5)。具体而言,先将N-甲基-1-萘甲胺和碘鎓盐底物1反应,原位得到氮丙啶盐中间体X,然后用不同的胺与氮丙啶盐反应。结果显示脂肪族胺(44、47、48)、脂肪族环胺(45、46)、芳香胺(49、50)、杂环胺(52、53)以及各种N-杂环(54-64)都可以与中间体反应得到相应的产物。值得一提的是,N-PMB-1-亮氨酸甲酯也能实现这一转化,以74%的收率、1:1的非对映选择性得到二胺衍生物51。接着,作者选择N-甲基-1-萘甲胺作为第二步胺化试剂,考察了第一步胺化的底物范围。环丙基(65)、烯基(66)、炔基(67、68)取代的胺(65-67)、四至七元饱和环胺(69-76)都能兼容该反应,以中等至较好的收率(43-85%)得到目标产物。最重要的是,含硫的胺也可以获得对应的产物77,该产物与止咳药普鲁米近的结构十分相似,进一步证明了该反应在药物合成领域中的应用价值。
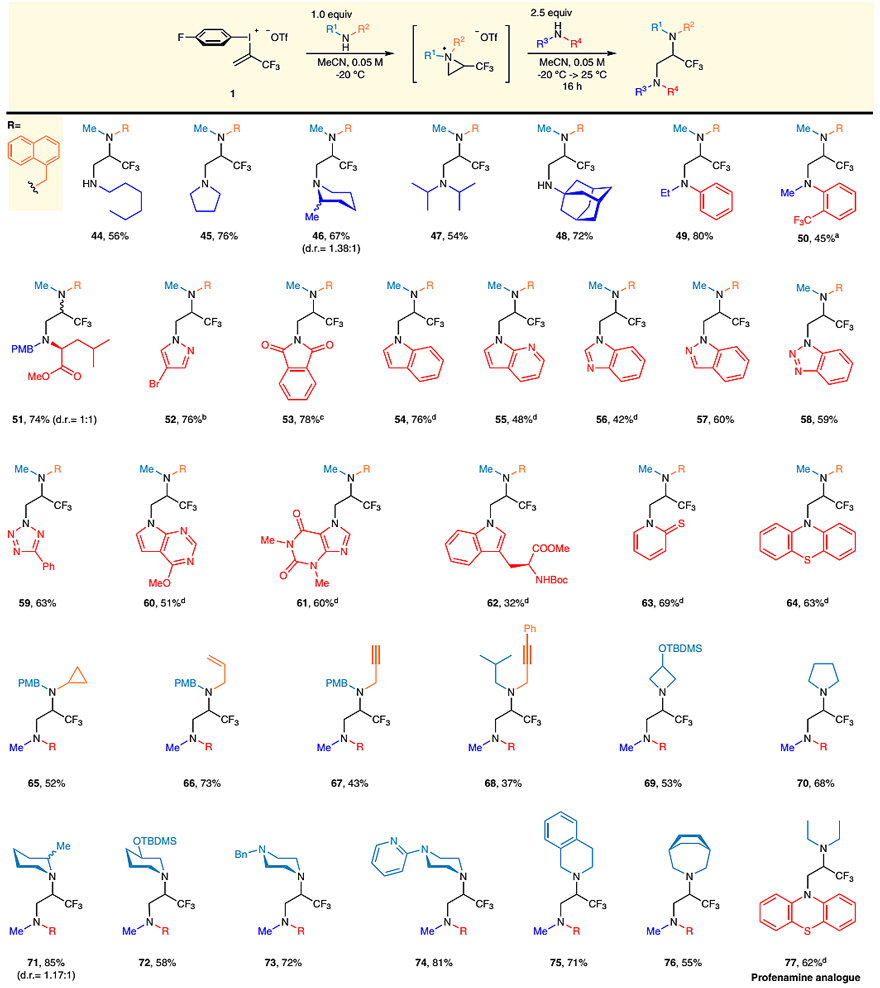
图5. 底物拓展-邻位异双胺化。图片来源:Nat. Commun.
既然胺可以亲核进攻氮丙啶盐中间体得到相应的产物,那么其它亲核试剂是否也可以呢?作者接下来的实验回答了这一问题(图6)。在得到氮丙啶盐中间体后,作者加入了不同的亲核试剂,各种(拟)卤化物(78-83)都能参与该反应,特别是亲核性较弱的氟负离子(F-)也能参与亲核进攻,以较好的收率(64-73%)得到1,1,1,3-四氟丙基单元(84、85),而文献中有关1,1,1,3-四氟丙基单元的制备方法则十分有限。此外,去质子化的苄醇(86)、4-溴苯酚(87)、苯甲酸钠(88)、各种硫醇(89-91)、膦(93、94)甚至碳亲核试剂(95-98)都能获得相应的产物。
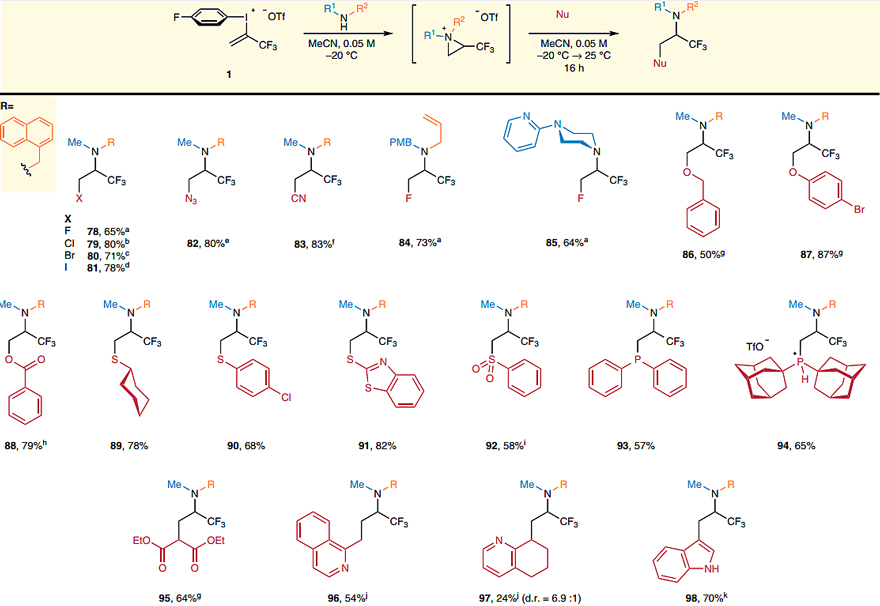
图6. 底物拓展-亲核试剂拓展。图片来源:Nat. Commun.
总结
Zoltán Novák教授课题组报道了无金属催化的碳碳双键的邻位双官能团化反应。具体而言,烯基碘鎓盐与胺反应后得到关键中间体——氮丙啶盐,后者再与亲核试剂反应得到相应的产物。该反应不仅适用范围广,官能团耐受性好,而且在药物合成领域中也有着非凡的价值。然而,笔者以为该反应最大的局限在于底物的种类。虽然作者巧妙地设计了亲电性很强的三价碘鎓盐,但底物仍然受限于一端无取代、另一端含强吸电子基(-CF3)的碳碳双键。至于碳碳双键的取代基如何影响反应,作者并没有提及。此外,由于缺乏手性催化剂,邻位双官能团化的立体选择性也有待讨论。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Vicinal difunctionalization of carbon–carbon double bond for the platform synthesis of trifluoroalkyl amines
Ferenc Béke, Ádám Mészáros, Ágnes Tóth, Bence Béla Botlik, Zoltán Novák
Nat. Commun., 2020, 11, 5924, DOI: 10.1038/s41467-020-19748-z
(本文由Ewald von S.供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号