ACS ABM 封面 | 线粒体靶向化学传感器对HClO和H₂S可视化检测并通过多响应荧光信号在体外和体内生物成像
英文原题: Mitochondria-Targeted Chemosensor to Discriminately and Continuously Visualize HClO and H2S with Multiresponse Fluorescence Signals for In Vitro and In Vivo Bioimaging 通讯作者: Zhan Zhou (周战)c and Jianliang Shen (沈建良)a,b a School of Ophthalmology & Optometry, School of Biomedical Engineering, Wenzhou Medical University, China b Engineering Research Center of Clinical Functional Materials and Diagnosis & Treatment Devices of Zhejiang Province, Wenzhou Institute, University of Chinese Academy of Sciences, China c Luoyang Key Laboratory of Organic Functional Molecules, College of Food and Drug, Luoyang Normal University, China 作者: Xiaojun He (何晓俊), Ziman Zheng (郑子曼), Feifan Zhang (张非凡), Chuchu Xu (许楚楚), Wei Xu (徐维), Lisong Ye (叶利松), Xiaoshuai Sun (孙潇帅), Zhan Zhou (周战) and Jianliang Shen (沈建良)
生物活性分子在细胞内环境中调节氧化还原平衡的过程中起着至关重要的作用,特别是在维持细胞器功能方面。为了探索细胞器中生物活性分子的关联和功能,必须开发一种化学传感器工具,该工具使用多响应荧光信号来区分和跟踪细胞器中的两个相关生物活性分子。但是,迄今为止,具有多响应功能的传感器的开发仍然是一项艰巨的任务。温州医科大学沈建良团队和洛阳师范学院周战团队共同提出了独特而实用的单一化学传感器(Mito-CTC),该传感器可通过多响应荧光信号监测线粒体中的HClO(作为氧化性物质)和H2S(作为还原性物质)。传感器对HClO和H2S的响应分别同时从红色变为绿色和蓝色通道发射,从而对线粒体内的还原/氧化性物质提供特定的信号响应。使用单个化学传感器,我们实现了细胞线粒体中外源和内源HClO和H2S的多通道生物成像。此外,传感器Mito-CTC的优异性能可用于揭示线粒体中HClO和H2S之间的关系。同时,由于具有良好的渗透性和低细胞毒性,Mito-CTC具有在细菌和斑马鱼中成像的能力。该传感器可以监测由氟西汀(抗抑郁药)引起的药物性肝损伤(DILI),以及由Mito-CTC通过对HClO的检测和成像来评估肝脏诱导的毒性程度,表明Mito-CTC具有评估药物进入肝脏毒性的潜在功能。
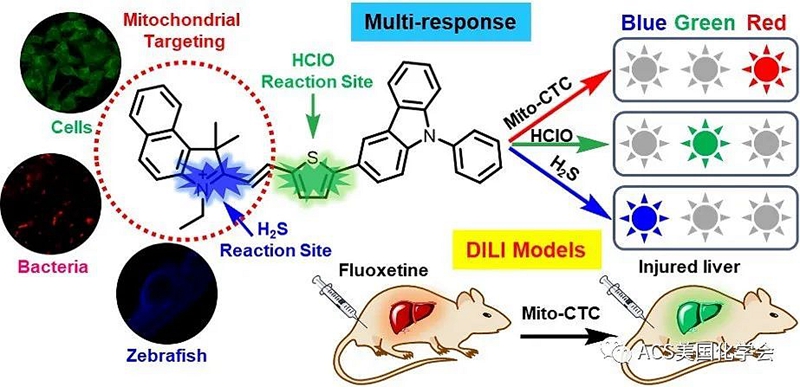
图1. 传感器Mito-CTC的合理设计并对HClO和H2S多响应机制的推测以及生物成像应用研究。
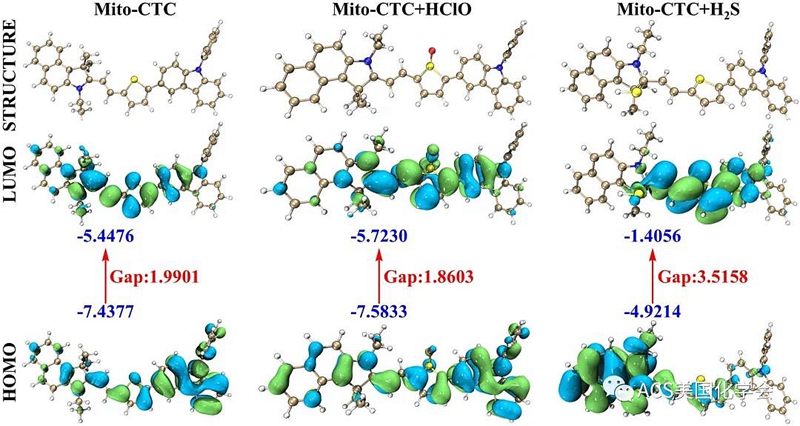
图2. 密度泛函理论计算:Mito-CTC,Mito-CTC+HClO和Mito-CTC+H2S的最优结构以及HOMO-LUMO能隙和轨道界面图。
基于密度泛函理论(DFT),探讨了传感器Mito-CTC与分析物结合前后光学行为变化的内部机制。该计算基于B3LYP/6-31G(d)的水平,并且使用高斯09程序来计算传感器的最佳几何形状和结构电子云分布。如图2所示,传感器Mito-CTC的最低空轨道(LUMO)(-5.4476 eV)主要分布在花菁结构部分,而最高占据轨道(HOMO)(-7.4377 eV)分布在咔唑结构部分上。然而,当Mito-CTC被HClO氧化时,Mito-CTC+ HClO分子的电子云的分布正好相反。LUMO(-5.7230 eV)主要分布在噻吩桥梁结构上,而HOMO(-7.5833 eV)则偏向咔唑分子骨架的一端。传感器Mito-CTC受H2S刺激后,Mito-CTC+ H2S的LUMO(-1.4056 eV)主要分布在噻吩桥梁结构上,而HOMO(-4.9214 eV)偏向花菁分子的一端。相反,它的骨架完全与Mito-CTC + HClO的电子云排列在一起。另外,通过计算能级差,可以知道探针与HClO反应后,Mito-CTC + HClO的HOMO-LUMO能级差(1.8603 eV)低于传感器Mito-CTC(1.9901 eV)。但是,Mito-CTC + H2S的HOMO-LUMO能级差(3.5158 eV)与传感器Mito-CTC的能级差之间存在明显的差距,表明H2S破坏了传感器的整个电子结构。
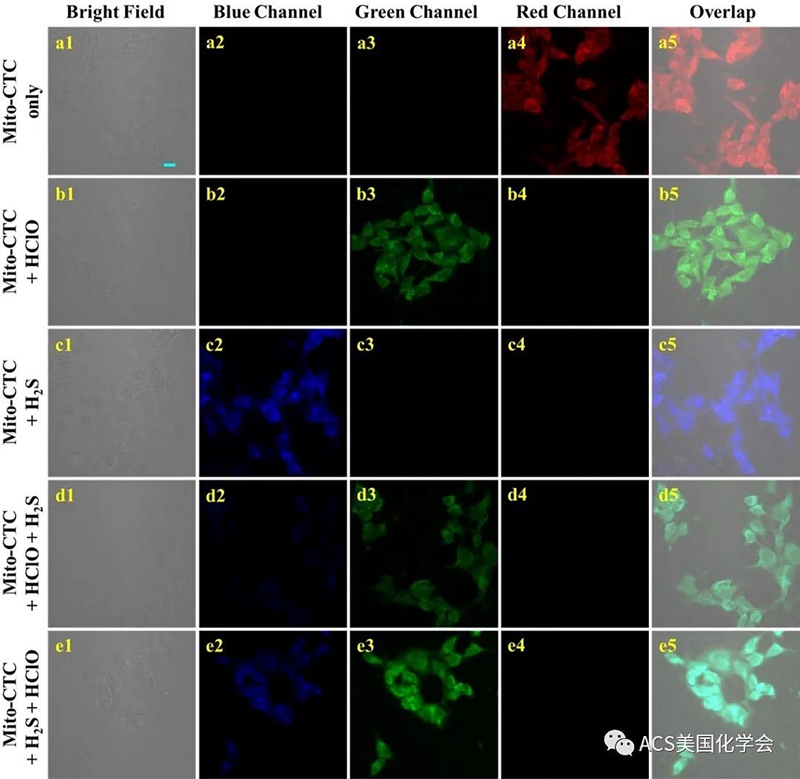
图3. 传感器Mito-CTC对RAW264.7细胞中HClO和H2S进行荧光成像研究。
研究了传感器Mito-CTC对HClO和H2S的响应的光谱性质,选择性和pH。结果表明,Mito-CTC能够在不同荧光信号下独特且连续地识别HClO和H2S。因此,通过对细胞内HClO和H2S进行生物成像来评估传感器的生物学应用。首先,MTT法用于评估Mito-CTC对RAW264.7和MDA-MB-231细胞的细胞毒性。结果表明,将传感器长时间孵育后,细胞的存活率超过85%,这表明传感器对细胞的细胞毒性较低。因此,该传感器具有低细胞毒性,可用于活细胞中HClO和H2S的生物成像研究。通过光谱分析,可以看出HClO和H2S的荧光响应信号不在同一通道中,这赋予了传感器对两种分析物的多通道成像功能。多通道模式用于可视化活细胞中外源/内源HClO和H2S的荧光。如图3所示,在仅用Mito-CTC预处理的RAW264.7细胞中,在红色通道中检测到了明显的荧光信号(蓝色和绿色通道中没有荧光信号)。另外,为了探索绿色通道中传感器对RAW264.7细胞中HClO的成像功能。当用HClO进一步处理装载有传感器的RAW264.7细胞时,在图3所示的绿色通道(b1-b5)中检测到强荧光信号,而红色通道的荧光信号消失了。这些数据表明,Mito-CTC可用于活细胞中的HClO成像。但是,当将装有传感器的RAW264.7细胞进一步用Na2S处理时,蓝色通道显示出显著的荧光信号,红色通道中的荧光信号消失了,这表明Mito-CTC传感器可以感应细胞中的H2S。验证Mito-CTC连续识别活细胞中HClO和H2S的能力。将装有传感器的RAW264.7细胞与HClO孵育30分钟,然后用PBS洗涤。活细胞用Na2S进一步处理30分钟。如图3(d1-d5)所示,绿色和蓝色通道中均出现大量荧光信号。此外,通过颠倒图3(e1-e5)中两种分析物的添加顺序,可以获得相同的结果。因此,总体结果表明,通过不同通道的成像,可以连续监测细胞内HClO和H2S的变化,从而实现Mito-CTC的连续监测,而不会彼此干扰。

图4. 传感器Mito-CTC对RAW264.7细胞中内源性HClO和H2S成像研究。
研究Mito-CTC是否可以在绿色通道的RAW264.7细胞中实现内源HClO的荧光成像。据报道,当脂多糖(LPS)刺激RAW264.7细胞时,它将产生内源性HClO。当用LPS(2 μg/mL)预处理RAW 264.7细胞时,在绿色通道中检测到清晰的荧光信号。期待结果,用LPS处理的RAW264.7细胞在绿色通道中检测到明显的荧光信号,如图4(b1-b5)所示。为了确认荧光增强是由内源性HClO引起的,N-乙酰半胱氨酸(NAC)被用作内源性HClO生成的抑制剂,可降低内源性HClO的浓度。当用200 μM NAC预处理刺激的RAW 264.7细胞时,绿色通道中的荧光信号消失(红色通道点亮),如图4所示(c1-c5),这意味着绿色荧光信号的变化通道产生内源性HClO。总之,Mito-CTC可以通过绿色和蓝色通道对细胞中的内源HClO和H2S进行荧光成像和跟踪。半胱氨酸可以被胞内胱硫醚β-合酶(CBS)催化产生内源性生物合成H2S。RAW264.7细胞用100 μM半胱氨酸预处理1小时,然后与未刺激的RAW264.7细胞相比,半胱氨酸用10 μM Mito-CTC处理刺激,半胱氨酸刺激的蓝色通道显示出色的荧光信号,而未刺激的显示蓝色通道。如图4(d1-d5)所示,红色通道中的荧光信号微不足道。为了验证观察到的荧光信号增加是引起内源性H2S诱导的。作为常用的抑制剂,炔丙基甘氨酸(PAG)可以抑制内源性H2S的产生。通过比较图像结果,当同时用半胱氨酸(100 μM)和PAG(200 μM)预处理RAW264.7细胞时,蓝色通道的荧光信号消失,如图4所示(e1-e5),表明实际上,荧光信号的变化会引起内源性生成的H2S。
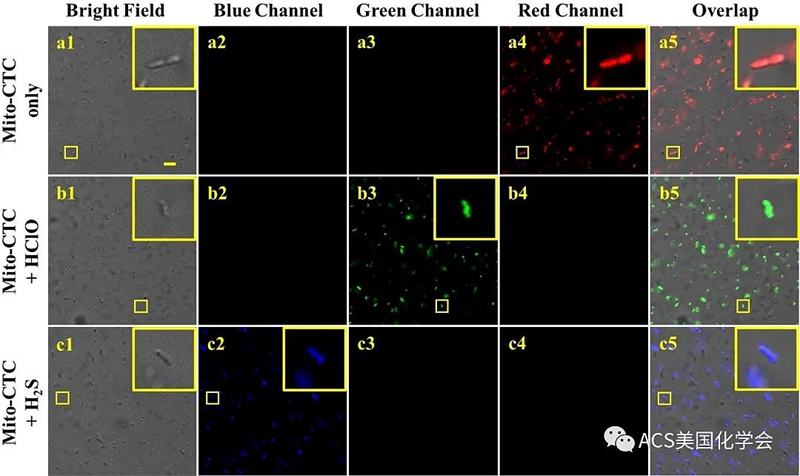
图5. 传感器Mito-CTC对细菌中HClO和H2S成像研究。
考虑到出色的荧光性能,我们将Mito-CTC用于细菌成像。细菌生物成像可以为细菌的发病机理和筛选相应的抗菌药物提供理论依据。活性氧和活性硫(ROS / RSS)与细菌的代谢和蛋白质活性调节密切相关。因此,ROS / RSS在细菌定植和宿主感染过程中起决定性作用。近年来,研究表明ROS / RSS与细菌和抗生素的相互作用过程有一定的关系。探索细菌中ROS / RSS含量的变化具有重要的生理意义,并为制定抗菌策略和临床医学安全性评估提供指导。此外,细菌中ROS(HClO)和RSS(H2S)的可视荧光监测将有助于了解抗菌机理。但是,细胞内环境极为复杂,有多个以上的活性物种参与同一生化过程。因此,使用单个化学传感器监测HClO和H2S逐渐成为研究热点。为了探索潜在的生物成像功能,使用Mito-CTC通过荧光成像检测铜绿假单胞菌(P. aeruginosa)中的HClO和H2S。如图5所示,用10 μM Mito-CTC染色的铜绿假单胞菌仅在铜绿假单胞菌的红色通道中显示出明显的荧光信号,而在蓝色和绿色通道中则可忽略不计。加入30 μM HClO 30分钟后,红色通道中的铜绿假单胞菌的荧光信号消失,绿色通道中的荧光信号随之出现,并且铜绿假单胞菌的“棒状”轮廓出现。如图5(b1-b5)所示,可以从缩放区域中的生物成像清楚地映射出。此外,当用H2S(150 μM)进一步处理装载了Mito-CTC的铜绿假单胞菌时,蓝色通道显示出较强的荧光信号,而红色通道中的荧光信号消失了,这意味着Mito-CTC可以被用于荧光可视化细菌中外源H2S,如图5(c1-c5)所示。结果证明,Mito-CTC可以实现铜绿假单胞菌中HClO和H2S的追踪,是研究细菌中HClO和H2S生物转化过程作图的潜在工具。
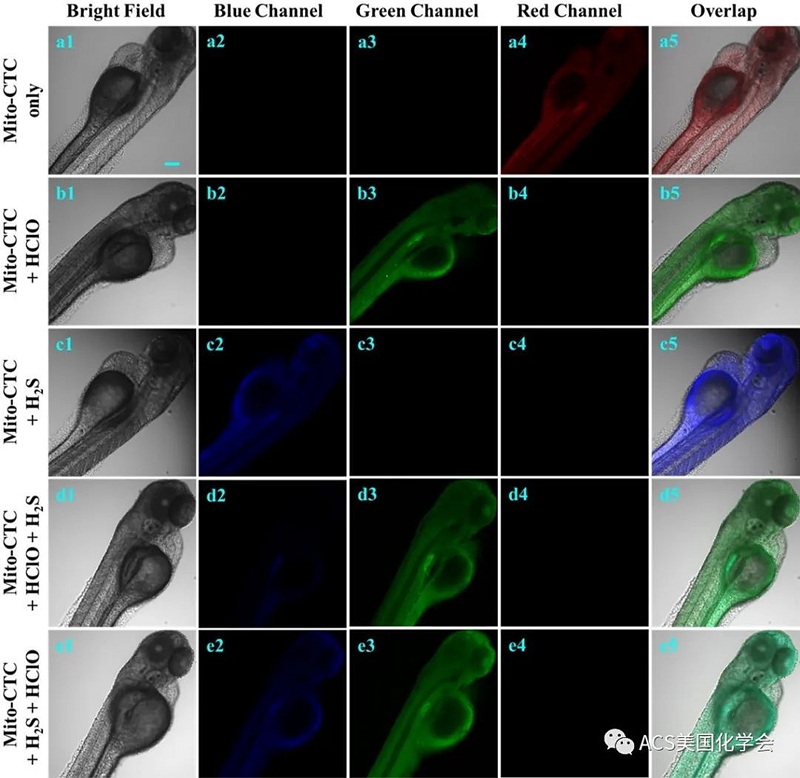
图6. 传感器Mito-CTC对斑马鱼中HClO和H2S成像研究。
在生物系统的代谢过程中,有机体的各个器官可以自发产生各种活性氧(ROS)和活性硫(RSS)。近来,大量的研究报告已经证明了用各自的荧光探针对ROS或RSS进行荧光成像的可能性。然而,在生物系统中,ROS和RSS通常同时存在,并且在具有多种反应的正常生物中,荧光探针的ROS或RSS的生物学成像仍然会相互干扰,这限制了探针的灵敏度和稳定性。在饲养活体动物的过程中,发生了许多生物过程,这些过程自然导致了ROS(HClO)和RSS(H2S)的产生。因此,为了研究Mito-CTC在具有多响应荧光信号的活生物体中对HClO和H2S的潜在生物学应用,选择了流行的脊椎动物模型四日龄斑马鱼作为我们的研究模型系统。如以上实验结果所述,Mito-CTC传感器显示出显着的荧光响应,并且可以有效地检测细胞和细菌中的HClO和H2S,还被用于对斑马鱼中的HClO和H2S进行生物成像。首先,将四天大的斑马鱼幼虫分别加入HClO和H2S喂入Mito-CTC。一段时间后,斑马鱼的存活率达到100%,这表明Mito-CTC毒性低,可用于斑马鱼的荧光成像。从图6(a1-a5),用Mito-CTC处理的斑马鱼在红色通道中诱导出明显的荧光信号。当使用Mito-CTC预处理斑马鱼,然后与HClO孵育时,如图6所示,从红色通道到绿色通道的荧光信号显着变化被监测。此外,将Mito-CTC与H2S孵育会在蓝色通道中引起令人惊讶的荧光,如图6(c1-c5)所示。随后,我们以不同顺序连续向斑马鱼中添加HClO和H2S,以进一步探索Mito-CTC连续性识别的能力。将装有传感器的斑马鱼与HClO孵育30分钟,用PBS缓冲液洗涤,再用H2S处理30分钟。不出所料,添加HClO和H2S后,图6(d1-d5)所示的蓝色和绿色通道中均出现了强烈的荧光信号。当我们更改两种分析物的添加顺序时,我们可以在图6(e1-e5)中看到类似的结果。以上结果表明,Mito-CTC可以通过三个不同的通道监测细胞内的H2S或HClO,并且两者都不会相互干扰。
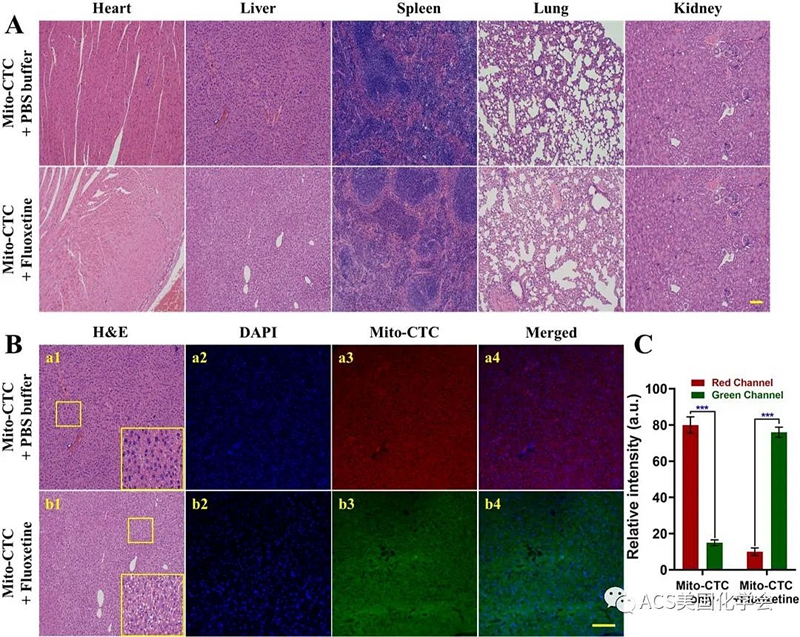
图7. 传感器Mito-CTC对药物诱导小鼠肝损伤荧光成像以及安全性评价。
在组织水平上监测由氟西汀引起的肝毒性变化,并了解其毒性机理。通常,将小鼠平均分为两组(实验组和对照组)。对于对照组,小鼠腹膜内注射PBS缓冲液,然后将Mito-CTC注射到尾静脉中60分钟。实验组腹腔注射PBS缓冲液(包括氟西汀),然后将Mito-CTC注入尾静脉60分钟。随后,将小鼠麻醉并分离它们的主要器官,将其切成薄片并用于生物成像。通过对小鼠主要器官组织的组织学分析来评估Mito-CTC的毒理学,以鉴定组织学变化。如图7所示,组织学检查证实,在此剂量(100 μM)下,Mito-CTC对处理过的小鼠的毒性在60分钟内可忽略不计,可以进一步进行生物成像测定。还通过各种治疗后将肝切片的H&E染色评估了药物诱导的肝损伤(图7A),其中氟西汀治疗组与Mito-CTC治疗组相比显示出最严重的肝损伤。此外,如图7B所示,在小鼠肝组织中观察到蓝色通道(DAPI)和红色通道(Mito-CTC)的荧光强度明显,这意味着正常肝组织中的HClO浓度较低。与细胞和斑马鱼中的结果一致,氟西汀治疗诱导绿色通道中荧光信号的产生(图7C),表明在药物处理后HClO上调。组织成像的结果证实了Mito-CTC可以通过上调小鼠肝脏中的HClO来实现,这归因于氟西汀诱导的肝毒性。
本研究的相关结果作为(内页)封面文章已发表于 ACS Applied Bio Materials, Volume 3, Issue 11。本项目得到了 National Natural Science Foundation of China, Zhejiang Provincial Natural Science of Foundation of China, Wenzhou Medical University 和 University of Chinese Academy of Science 的支持。
扫描二维码阅读英文原文,或点此查看原文

ACS Applied Bio Materials, 2020, 3, 11, 7886-7897
Publication Date: September 8, 2020
https://doi.org/10.1021/acsabm.0c01029
Copyright © 2020 American Chemical Society

ACS Applied Bio Materials创刊于2018年7月,仅在线出版,12期/年。旨在为读者及作者提供生物相关功能材料的设计及其应用的突破性与原创性研究,是将材料学、工程学、生物学、医学及化学知识融合于重要的生物应用的前沿期刊。
涵盖研究领域包括生物材料,生物医用材料,生物能源,生物催化,生物电子,生物污损与防污材料,仿生材料,生物分子成像/传感,药物传递/靶向,自修复材料,抗菌/抗微生物及抗癌生物材料等。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号