Science:Pd催化C-H键氧化芳基化效果不好?试试这种醌
均相催化在基础研究和工业生产中具有至关重要的作用。1959年,德国Wacker-Chemie公司在Pd催化的作用下实现了乙烯和水的氧化偶联(Angew. Chem., 1959, 71, 176-182),从此开启了均相钯催化的氧化偶联反应的新时代。此后不久,化学家陆续报道了钯催化的芳烃与联芳基的C-H键氧化偶联反应,但是这些反应的催化效率和区域选择性都较差。事实上,大多数PdII/0-催化的偶联反应(包括氧化性和非氧化性)都可分为两大类:(1)烯基化反应(如Heck反应、Fujiwara-Moritani反应等),通过PdII-alkyl中间体的β-H消除得到目标产物(图1A,左);(2)芳基化反应(如Suzuki-Miyaura反应、Negishi反应等),通过PdII-aryl中间体的还原消除得到目标产物(图1A,右)。尽管氧化反应(图1A)与非氧化交叉偶联反应在机理上十分相似,但它们通常表现出较差的催化性能,因此需要使用一种或多种化学计量的氧化剂(如CuII、AgI和苯醌)。如图1B所示,大多数反应的催化剂转化(turnovers, TOs)数低于10,尽管Ac保护吲哚的芳基化反应的TOs较好(32),但是该反应需要3 equiv. Cu(OAc)2作为氧化剂、30 equiv.苯作为偶联试剂。
2012年,美国威斯康星大学麦迪逊分校的Shannon S. Stahl教授(点击查看介绍)课题组发现,使用O2作为氧化剂,通过β-H消除进行的Pd催化的氧化反应要比通过还原消除进行的反应更有利(Acc. Chem. Res., 2012, 45, 851–863)。与此同时,余金权教授等人通过PdII/0催化的C-H键烯基化反应和芳基化反应证实了这一现象(Science, 2010, 327, 315-319; J. Am. Chem. Soc., 2010, 132, 14137-14151; J. Am. Chem. Soc., 2012, 134, 4600-4606; J. Am. Chem. Soc., 2011, 133, 18183-18193),当两者均使用1 atm. O2作为氧化剂时,烯基化反应的TOs高达455(图1C,左),而芳基化反应的TOs仅为13(图1C,右)。在此基础上,Shannon S. Stahl教授课题组对图1C中Pd催化的C-H键芳基化反应进行了机理研究,开发了一种改良的催化体系,即使用2,5-二叔丁基对苯醌(2,5-tBu2BQ)作为助催化剂,有效地利用O2作为氧化剂,反应不仅收率高,而且钯催化剂的TOs大幅提高(> 1900)。相关成果发表在Science 上。
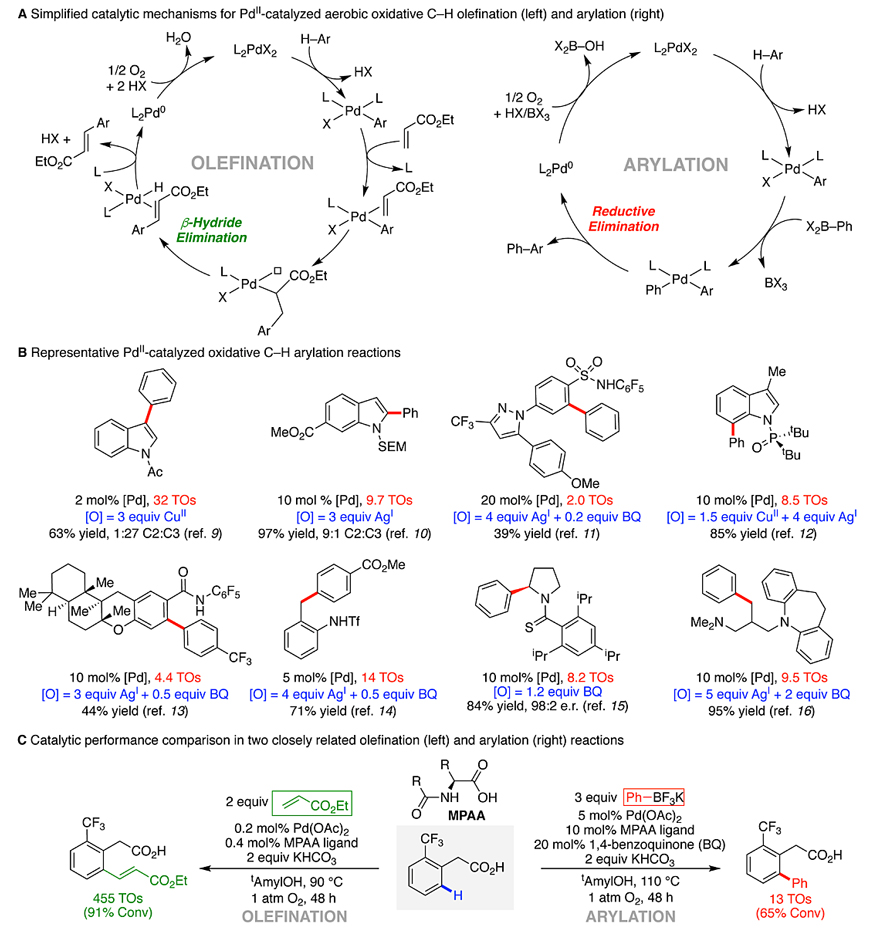
图1. 钯催化的C-H键氧化反应及所面临的挑战。图片来源:Science
首先,作者选择2-(三氟甲基)苯乙酸钾(1)与芳基硼酸频哪醇酯(2)作为底物,当在1 atm O2下进行反应时,能以83%的NMR收率得到芳基化产物3(图2A),比最初的报道的产率(65%)有所提高。最初的实验表明1,4-苯醌(BQ)是该反应的关键助催化剂,在没有BQ的情况下,芳基化产物可忽略不计(1%),主要得到氟苯(ArF-H)。反应时间进程分析表明在反应刚开始时速率较快,其次是较慢的稳态速率(图2B)。氧气压力的增加对动力学爆发(kinetic burst)没有影响,但对爆发后的速率有明显的影响,并与氧气压力的变化成正比。为此,作者提出了可能的催化机制(图2C),其中动力学爆发可能是由于PdII/BQ对底物进行快速的化学计量氧化偶联引起的,而爆发后阶段可能由还原性Pd催化剂的循环氧化引起。此外,作者尝试使用叔丁基对苯醌(tBuBQ),结果显示其对反应时间进程没有影响(图2D)。相比之下,使用2,5-二叔丁基对苯醌(2,5-tBu2BQ)则提高了速率,并且在初始催化循环后速率没有降低。
随后,作者对不同催化组分的作用进行了深入研究。将底物1和PdII(OAc)2溶于tAmylOH中并在64 °C下反应,结果显示反应没有进行,这与先前的结果一致(即在没有MPAA配体的情况下,C-H键活化非常缓慢)。如图2E所示,加入MPAA配体引发了palladacycle(源于底物的C-H键活化)的形成,随后加入芳基硼酸酯2导致副产物ArF-H的形成,且没有观察到C-H键芳基化产物3的生成,仅在添加2,5-tBu2BQ后才观察到3的出现。这些结果与图2A中的数据一致,表明ArF-H是在无BQ的情况下进行反应所获得的产物。事实上,2,5-tBu2BQ浓度的变化进一步证实了ArF-H和3之间存在竞争关系(图2F)。另外,在6.9 atm O2下进行反应时,发现palladacycle迅速形成并以催化剂的静止状态持续存在(图2G),这些结果表明当使用2,5-tBu2BQ作为助催化剂时,palladacycle是催化剂的稳定态(resting state)。

图2. 钯催化C-H键芳基化反应的动力学分析和光谱分析。图片来源:Science
如图3A所示,作者提出了可能的反应机理。首先,MPAA配体促进了I中底物的C-H键活化,形成palladacycle II,后者与芳基硼酸酯发生转金属化生成二芳基-PdII物种III,该物种可通过质子化生成副产物ArF-H并再生palladacycle II;或者通过醌促进的还原消除反应生成芳基化产物3和Pd0-醌加合物IV,后者与O2反应再生PdII催化剂。为了进一步研究醌助催化剂的作用,作者对PdII-二芳基物种Pd(Ar)(Ar’)进行了密度泛函理论(DFT)计算(图3B)。结果显示尽管BQ和2,5-tBu2BQ都不能与Pd(Ar)(Ar’)形成良好的加合物;但是与无醌反应相比,两者都能降低还原消除的动力学势垒。此外,醌促进的还原消除的过渡态能量与质子化途径的过渡态能量十分相似,这与ArF-H和3之间存在的竞争关系相一致(图2F)。

图3. 反应机理研究。图片来源:Science
在此基础上,作者对反应条件进行了优化(图4A)。在Pd(OAc)2(5 mol%)、2,5-tBu2BQ(20 mol%)和3 atm O2的作用下,能以> 99%的收率得到目标产物3,此时的TOs为20。在保持Pd:MPAA:2,5-tBu2BQ(1:2:4)比例不变的情况下,将催化剂负载量降低到0.15 mol%,TOs为147,但是却生成了大量的副产物ArF-H和4,4'-二氟联苯(ArF-ArF),后者是由芳基硼酸酯的自身偶联产生的。将MPAA的负载量增加到10 mol%就可以避免ArF-ArF的生成,同时Pd催化剂的 TOs增加到373。随后,改变醌的负载量以及MPAA配体(Ac-Ile-OH),便能以定量的收率得到3,此时的TOs 高达667。接着,作者考察了不同的醌试剂(图4B),发现醌上取代基的数量和大小对反应的产率和催化剂的TOs均有促进作用,当Pd催化剂的负载量为0.05 mol%且选择2,5-tBu2BQ为助催化剂时,TOs高达1960,并且目标产物3的产率接近定量。
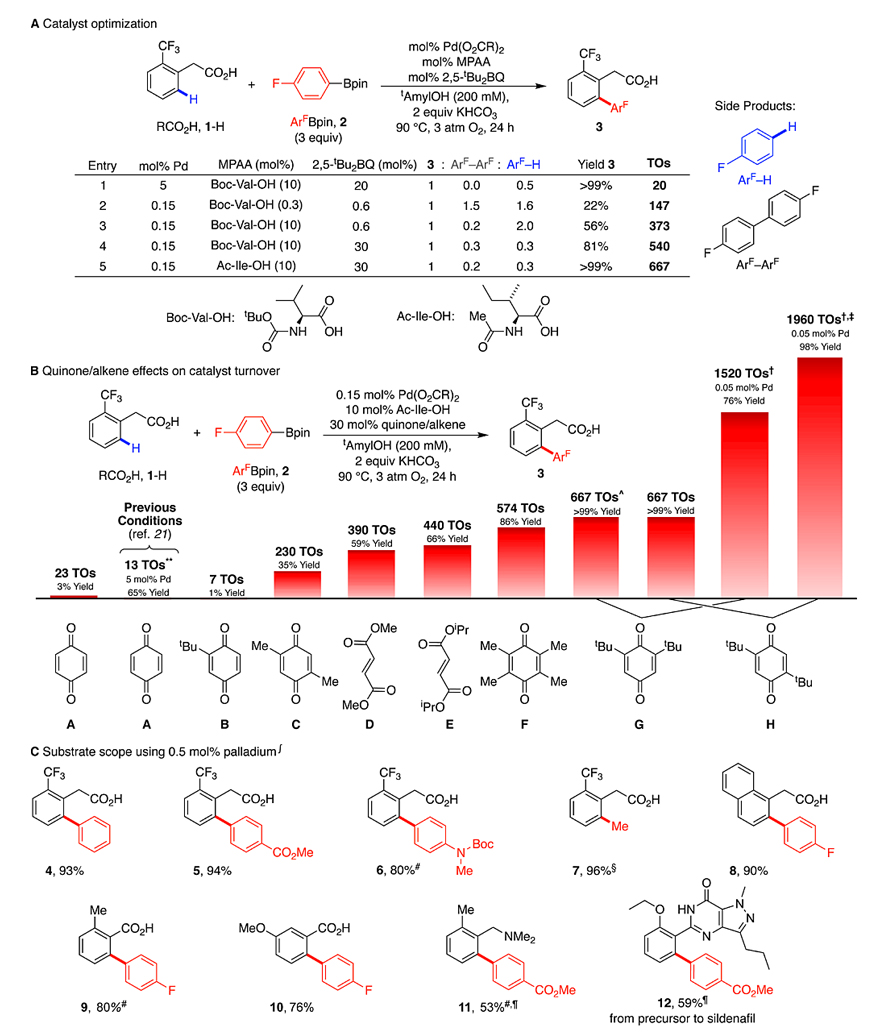
图4. 低负载量催化剂的催化性能。图片来源:Science
最后,作者在0.5 mol%Pd催化剂的作用下对反应的底物范围进行了考察(图4C)。酯基、Boc-胺取代的芳基硼酸酯以及甲基硼酸酯都能以较好至优异的分离收率得到所需的产物(4-7)。此外,1-萘乙酸和甲基、甲氧基取代的苯甲酸也能实现这一转化,以较高的收率得到产物(8-10)。含有中等氮导向基团的底物(11)、西地那非前体(12)也能兼容该反应,尽管收率中等。
总结
尽管Pd(II)催化的C-H键氧化反应可以简化药物分子、农用化学品和其它复杂有机分子的合成步骤,但是现有的反应催化活性较差,且往往需要较高负载量的Pd催化剂和过量的氧化剂。Shannon S. Stahl教授课题组在Pd催化的C-H键芳基化反应研究中,发现醌助催化剂至关重要,它不仅可以降低还原消除的动力学势垒,还能减少副产物(ArF-H)的生成。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Tailored quinones support high-turnover Pd catalysts for oxidative C–H arylation with O2
Chase A. Salazar, Kaylin N. Flesch, Brandon E. Haines, Philip S. Zhou, Djamaladdin G. Musaev, Shannon S. Stahl
Science, 2020, DOI: 10.1126/science.abd1085
导师介绍
Shannon S. Stahl
https://www.x-mol.com/university/faculty/98
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号