Hartwig组Nature:由内烯合成手性胺的新方法
手性胺类化合物广泛存在于药物分子、农用化学品以及功能材料中。除了它们本身的生物活性外,手性胺也可以作为手性催化剂、拆分试剂及手性辅基。因此,发展高效的手性胺合成方法就显得极其重要。传统的合成方法主要有以下几种:化学/酶促还原胺化、氢化、亚胺的亲核加成及亲核取代反应,但是这些方法往往需要由烯烃衍生而来的官能团参与。相比之下,烯烃的加氢胺化反应则最直接、最高效,因为该方法仅仅需要两类最基本的原料(烯烃和胺),并且该反应具有100%的原子经济性。在烯烃的不对称加氢胺化领域中,化学家已经发展了氨基对共轭烯烃及苯乙烯类化合物的不对称加成反应。但是,有关氨基对未活化烯烃的加成反应却鲜有报道。尽管近年来有关形式上的烯烃不对称加氢胺化反应取得了一定的进展(如麻省理工学院Buchwald课题组的一系列工作),但是这些反应需要当量的硅烷试剂和亲电的氨基试剂,从而降低了反应的原子经济性。
事实上,发展内烯的不对称加氢胺化反应仍存在许多挑战。第一,由于N-H键的键能极高,使得氨基对内烯的加成反应在热力学上驱动力往往很弱;同时,由于烯烃和胺类化合物都是亲核试剂,因此将两类试剂结合在一起的动力学能垒很高(图1a)。第二,驱动烯烃加氢胺化反应的催化剂往往也能参与其它副反应(如烯烃的异构化反应、β-H消除),其中异构化反应的速率往往比目标氨基加成速率更快,因此会不可避免的会产生混合产物,使得反应的选择性极差(图1b)。几年前,美国加州大学伯克利分校的John F. Hartwig教授(点击查看介绍)课题组报道了中性Ir催化剂驱动的酰胺(吲哚)N-H键对端烯的加成反应(J. Am. Chem. Soc., 2012, 134, 11960; J. Am. Chem. Soc., 2014, 136, 3200)。机理研究表明,反应经历了Ir催化剂对N-H键的氧化加成,氧化加成中间体对双键的加成迁移,以及最后C-H键的还原消除等步骤。在此基础上,作者设想能否把中性的Ir催化剂改为阳离子Ir催化剂,这样反应中间体对双键的加成迁移就会更快,从而有可能使目标反应成为主反应;此外,作者也设想增强烯烃和氨基的结合力,从而降低反应的过渡态能垒。近日,他们报道了阳离子Ir体系催化的未活化内烯的分子间不对称加氢胺化反应(图1c)。具体而言,选择2-氨基吡啶类化合物作为胺试剂,这是因为导向基团的存在有利于N-H键对催化剂的氧化加成,同时氧化加成后生成的中间体对双键进行加成时会形成一个六元环中间体,从而能够有效地抑制β-H消除过程。此外,通过调节2-氨基吡啶的取代基,可以进一步调控底物与催化剂的弱相互作用,从而调节反应的立体选择性。相关成果发表在Nature 上。
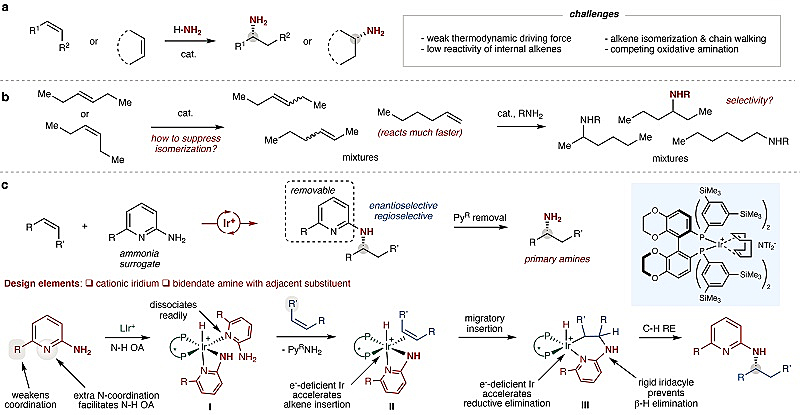
图1. 研究背景及该文工作。图片来源:Nature
首先,作者选择cis-4-辛烯为内烯模板底物,在[Ir(coe)2Cl]2(2.5 mol%)、(S)-DTBM-SEGPHOS(6 mol%)和NaBARF(6 mol%)的作用下对不同的2-氨基吡啶进行了筛选(图2a),结果表明不同的2-氨基吡啶活性差异巨大。简单的2-氨基吡啶没有活性,而6位为甲基的2-氨基吡啶活性最高。在此基础上,作者研究了不同手性配体及抗衡离子对目标反应的影响。结果表明当手性配体为(R)-TMS-SYNPHOS (L4)、抗衡离子为NTf2、反应温度为120 ℃时,能够以78%的收率、89%的位置选择性(4-位选择性)和97%的对映选择性得到目标产物(1,图2b)。

图2. 不对称胺化反应的条件优化。图片来源:Nature
在最优条件下,作者对烯烃的底物范围进行了考察。对于链状内烯而言,不论是对称内烯还是不对称内烯都能很好的参与该反应,且反应的对映选择性都在90%以上。利用该方法,对称链状内烯可以转化为含有直链烷基(1)、芳基取代的烷基(2)、带支链的烷基(3)、硅醚取代基(4)、烷氧取代基(5)及酯基(6)的氨基加成产物。对于非对称链状内烯,反应会得到位置异构体(位置选择性:2:1-10:1),并且可以兼容邻苯二甲酰亚胺(7-8)、磺酰胺(9)、硅醚(10)、酯基(11)以及(杂)芳基醚类化合物(12-14),产率为53%-82%(图3a)。除了链状内烯外,作者也考察了环状烯烃的反应活性。结果表明不同环系(5-8元环)的烯烃都能参与该反应,以中等至优异的收率(53%-90%)和优异的对映选择性(90-92% ee)得到加氢胺化产物(15-23)。值得一提的是,对称的环状烯烃得到单一的目标产物,而非对称环烯得到的反应产物则为混合物(24-25),产率中等(72%,52%),ee值中等至优异(69%,92%,图3b)。最后,作者展示了吡啶基团的脱保护过程。在还原条件下,氨基吡啶可以在手性保持的同时以较高的产率(71-85%)转化为一级胺(26、27),从而使该方法具有更大的应用价值(图3c)。

图3. 烯烃的底物范围。图片来源:Nature
在研究了烯烃的底物范围后,作者对反应机理进行了研究(图4)。首先,作者进行了同位素标记实验,将N,N-二氘-6-甲基-2-氨基吡啶与取代的环戊烯在标准条件下进行反应,结果显示加成产物中的D原子与氨基为syn-构型,从而证实了该加成反应是通过syn-加成过程进行的,这样就排除了氨基对金属催化剂活化烯烃的直接亲核加成,而间接地支持了金属氧化加成中间体对烯烃的迁移加成机理(图4a)。动力学实验表明反应速率与铱催化剂为一级相关,与烯烃浓度为正相关,而与胺类底物浓度为负相关,从而说明了过量胺类底物会可逆地占据催化剂的活性位点(图4b)。为什么6-甲基-2-氨基吡啶活性极高而2-氨基吡啶没有活性?为了进一步研究这个问题,作者使用等量的6-甲基-2-氨基吡啶和2-氨基吡啶与cis-4-辛烯在标准条件下进行反应,结果显示反应完全被抑制,这表明2-氨基吡啶与催化剂的结合力太强而不可逆,从而抑制了催化剂的反应活性(图4c)。最后,作者运用密度泛函理论(DFT)对烯烃的迁移插入进行了计算,结果表明该胺化反应的立体选择性由电子效应和位阻效应共同控制,同时金属中间体对烯烃的迁移加成反应是该反应的决速步骤(图4d)。

图4. 反应机理研究。图片来源:Nature
总结
在这篇文章中,Hartwig课题组报道了阳离子Ir体系催化的6-甲基-2-氨基吡啶对不同未活化内烯的不对称加成反应。该反应条件温和、产率优异、立体选择性高。该反应的关键在于电正性Ir催化剂的使用以及6-甲基-2-氨基吡啶作为氨基亲核试剂。虽然该反应利用了单一的氨基亲核试剂,但是加成产物中的吡啶基团可以简单地脱除且手性保持,从而大大拓展了有机胺的产物范围。考虑到该方法的易操作性、原料的易得性及产物的重要性,相信该方法将会在有机合成中得到广泛的应用。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic asymmetric addition of an amine N–H bond across internal alkenes
Yumeng Xi, Senjie Ma, John F. Hartwig
Nature, 2020, DOI: 10.1038/s41586-020-2919-z
导师介绍
John F. Hartwig
https://www.x-mol.com/university/faculty/40
(本文由波纹供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号