Nature:可见光诱导的蛋白质侧链修饰
蛋白质是组成人体一切细胞、组织的重要成分,没有蛋白质就没有生命。作为一类基本的生物大分子,其生物活性往往由构成蛋白质的氨基酸侧链所决定。经过漫长的进化过程,细胞已经具有非常成熟的蛋白质修饰功能,但是只能针对天然氨基酸进行修饰,对非天然氨基酸却无能为力。和生物过程相比,通过化学反应直接修饰蛋白质则没有这些限制。虽然利用有机反应来修饰蛋白质具有很多优点,但是也存在许多挑战。第一,反应需要在水相中进行,因为蛋白质往往只能溶于水;第二,所使用的化学反应条件必须足够温和,否则,蛋白质会在反应条件下失活;第三,所使用化学反应的选择性要足够好,因为蛋白质往往具有许多不同性质的官能团。近年来,化学家们发展了许多适合蛋白质修饰的化学反应,其中一类重要的反应就是基于单电子转移的自由基反应。利用自由基反应来官能团化蛋白质有许多优势:第一,自由基往往可以与水及蛋白质中含有的羧基、氨基、羟基等极性基团兼容;第二,通过调控自由基反应原料,反应往往具有非常高的选择性。在自由基化学中,脱氢丙氨酸(Dha)是一类活性很高的自由基受体(radical acceptor),可以与各种碳中心自由基反应形成稳定的碳碳键。此外,如何选择一种与蛋白质兼容的自由基生成方法则是另外一个需要克服的难题。在过去的10年里,通过可见光诱导产生自由基受到了化学家们的广泛关注,因为该过程条件温和、官能团兼容性好。
在此基础上,英国牛津大学的Benjamin G. Davis教授和Veronique Gouverneur教授课题组合作,报道了一种新型的可见光诱导的蛋白质官能团化的方法(图1)。即分别利用邻苯二酚硼酸酯(BACED)和吡啶二氟烷基砜(pySOOF)作为自由基前体来实现含有脱氢丙氨酸蛋白质的官能团化。该反应不仅条件温和,还能实现超过50种残基/侧链的修饰,甚至还能耐受酰胺、叠氮、酯基、醚、卤素、甲氨基等官能团。该工作近期发表在Nature 上。
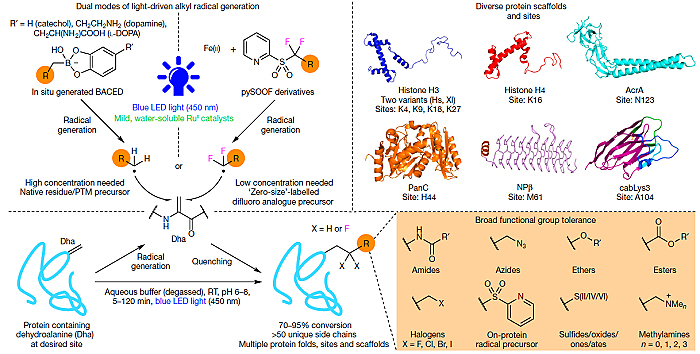
图1. 该文工作。图片来源:Nature
尽管可见光产生自由基的方法多种多样,但是要想选择一种与蛋白质兼容的方法却并不容易。这是因为可见光诱导产生自由基往往是通过氧化还原过程进行的,而蛋白质中也存在着许多具有氧化还原活性的官能团(比如巯基、羧基与苯酚)。显然,符合标准的氧化还原条件需要足够温和,这样才能选择性地与目标自由基前体反应,而不与蛋白质侧链反应。经过一系列条件摸索,作者最终发现:(1)邻苯二酚硼酸酯(BACED)在蓝光LED(450 nm)照射下,可以被水溶性的RuII催化剂氧化为烷基自由基;(2)吡啶二氟烷基砜(pySOOF)在光与二价铁的协同作用下,可以被水溶性的RuII催化剂还原为相应的二氟烷基自由基。在确定了关键的反应物后,作者进一步优化了反应条件,最终确定了最优条件:在除氧的缓冲溶液(pH 6-8)中,通过选用合适的光敏剂,在450 nm蓝光下于室温照射5-120 min后,含有脱氢丙氨酸的蛋白质便可以与相应的自由基前体形成目标碳碳键(图1)。

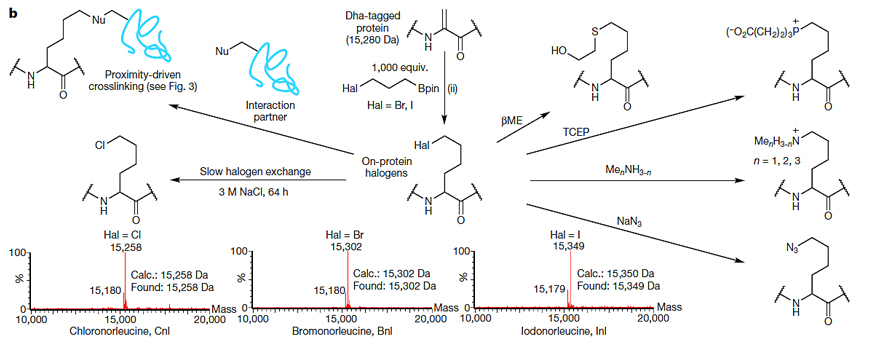
图2. 利用自由基官能团化蛋白质。图片来源:Nature
在最优条件下,作者对不同的蛋白质侧链进行了修饰。首先,在标准条件下,9位为脱氢丙氨酸的组蛋白可以与碘代的pySOOF(I-pySOOF)反应形成目标碳碳键。由于I-pySOOF存在两个还原性基团,因此在形成碳碳键后,加成中间体还可以产生另外一个自由基。通过与不同的自由基受体反应,该自由基中间体可以被进一步修饰,比如形成Cγ-杂原子键(即与TEMPO反应形成Cγ–Oδ键;与Ph2Se2反应形成Cγ–Seδ键);此外,还可以与不同的双键受体反应形成Cγ–Cδ键。不论是单/双取代双键受体,还是三取代双键受体,都能实现这一转化,尽管转化率较低。需要指出的是,该自由基中间体也可以与另外一个含有脱氢丙氨酸的蛋白质反应形成蛋白质二聚体,并且反应中所有的修饰产物都被质谱或者凝胶电泳所证实(图2a)。随后,作者利用邻苯二酚硼酸酯对含有脱氢丙氨酸的组蛋白进行修饰。由于邻苯二酚硼酸酯产生自由基的条件是氧化性条件,鉴于碳卤键在氧化性条件下能稳定存在,因此作者选择含有卤原子的邻苯二酚硼酸酯作为自由基前体,这样添加到蛋白质上的碳卤键就可以作为另一个反应位点对蛋白质进行进一步的修饰。在标准条件下,脱氢组蛋白与邻苯二酚硼酸酯反应形成碳碳键后,蛋白质上的碳卤键便可与各种亲核试剂(比如巯基、三价磷、胺、叠氮以及卤素)进行亲核取代反应,从而得到多种类型的蛋白质(图2b)。需要强调的是,该碳卤键反应位点也可以与其他蛋白质反应,从而可以实现不同蛋白质的交联。
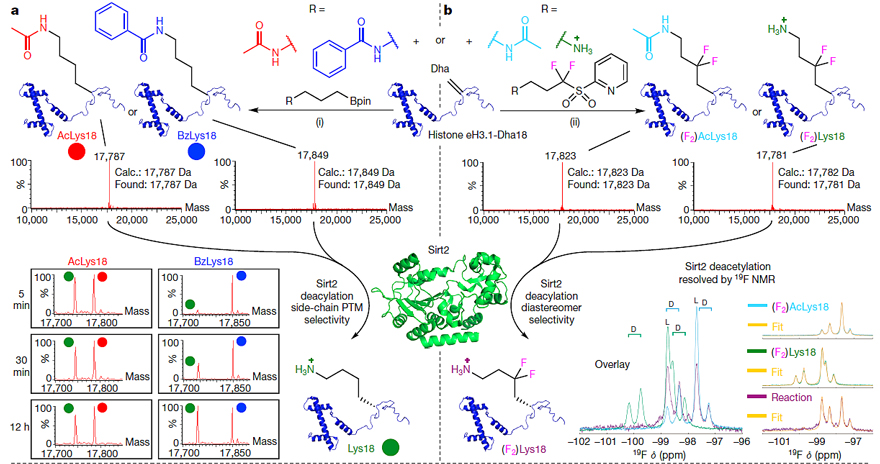

图3. 修饰蛋白的酶活性研究。图片来源:Nature
随后,作者对所获得的非天然蛋白的生物活性进行了研究。通过氧化邻苯二酚硼酸酯(BACED)的方法,他们分别获得了18位赖氨酸为乙酰基保护(AcLys/KAc)和苯甲酰基保护(BzLys/KBz)的组蛋白。并用去乙酰化酶Sirt2评估了这两种非天然蛋白的活性。动力学数据表明18位赖氨酸被乙酰基保护的组蛋白脱保护的速率远远大于被苯甲酰基保护的组蛋白脱保护速率(即(kcat/KM,app(eH3.1-K18Ac) : kcat/KM,app(eH3.1-K18Bz) > 100:1)。反应5 min后,乙酰基保护的蛋白脱保护产物已有50%,而同样的反应时间内苯甲酰基保护的蛋白脱保护的产物量则可以忽略不计(图3a)。除了氧化硼酸酯的方法,作者也展示了还原pySOOF方法在蛋白质活性研究中的应用。由于pySOOF可以向蛋白质中引入氟原子,而19F NMR的灵敏度极高,所以该方法为利用19F NMR研究蛋白质活性提供了一种强有力的手段。如图3b所示,作者展示了用19FNMR来追踪整个脱乙酰基化过程。正如前文所说,在氧化条件下,利用含有卤原子的邻苯二酚硼酸酯可以向目标蛋白中添加碳卤键活性位点,这样就可以提供一种相邻蛋白交联的方法。根据文中报道的方法,作者分别在组氨酸的4位、9位、27位添加了含有一级溴原子的侧链(Bhn)。由于与组蛋白有相互作用的KDM4A蛋白里含有各种巯基,这样邻近的巯基就可以与溴原子反应生成硫醚,进而实现了组蛋白与KDM4A蛋白的交联。值得一提的是,KDM4A中的巯基会与Zn离子配位,但是当其中的一个巯基生成硫醚后,巯基与Zn离子的配位能力就会减弱,从而释放出Zn离子,所以通过检测释放Zn离子的浓度就可以判定两种蛋白质的交联情况。当然,利用凝胶电泳技术能更直观的检测蛋白质交联的效果(图3c)。
总结
在这篇文章中,Davis课题组和Gouverneur课题组报道了一种新型的蛋白质官能团化的方法,即在可见光照射下,分别利用邻苯二酚硼酸酯和吡啶二氟烷基砜作为自由基前体,实现了含有脱氢丙氨酸蛋白质的官能团化。这两种自由基前体简单易得,易于修饰,这样就为向蛋白质中添加任意官能团提供了便利。同时,这两种自由基前体性质互补,一种为还原性自由基,一种为氧化性自由基,进一步拓展了自由基与脱氢丙氨酸反应的使用范围。考虑到该方法的简便性及高效性,可以预见,该方法在合成各种非天然蛋白质以及化学生物学领域中将会发挥非常重要的作用。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Light-driven post-translational installation of reactive protein side chains
Brian Josephson, Charlie Fehl, Patrick G. Isenegger, Simon Nadal, Tom H. Wright, Adeline W. J. Poh, Ben J. Bower, Andrew M. Giltrap, Lifu Chen, Christopher Batchelor-McAuley, Grace Roper, Oluwatobi Arisa, Jeroen B. I. Sap, Akane Kawamura, Andrew J. Baldwin, Shabaz Mohammed, Richard G. Compton, Veronique Gouverneur, Benjamin G. Davis
Nature, 2020, 585, 530–537, DOI: 10.1038/s41586-020-2733-7
(本文由波纹供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号