E-Biobarcode Assay:基于分子传译技术与纳米结构电极的一体化癌症体外诊断平台
灵敏且准确的蛋白分析在疾病诊断、监控和管理方面有重要的意义。但是现有的实验室级蛋白质分析仪器由于它们的成本高且针对非技术用户的操作规程复杂,不能对初级医疗机构、患者卧床或家庭环境中的患者进行频繁的筛查和监测。电化学检测由于其响应迅速及检测灵敏度高以及便于级联尤其适用于即时蛋白检测。然而,目前的电化学检测方法难以做到从复杂临床样品中,以“sample-in-answer-out(SIAO)”的方式实现一步快速检测。其主要原因是测定过程对涉及洗涤、靶标标记和添加试剂以处理样品以及放大和转导信号等多个步骤的依赖。
为解决这个技术难题,四川大学/加拿大布鲁克大学李峰课题组与麦克马斯特大学Leyla Soleymani课题组合作将分子传译技术与纳米结构电极相结合,开发了一种基于电化学的“生物条形码(e-biobarcode)”方法,以SIAO的方式即时检测前列腺特异性抗原。具体而言,该方法集成了:(1)临近诱导生物条形码检测,设计用于通过一锅法操作进行电化学信号转导,(2)使用三维纳米结构的电极进行电化学检测以提高灵敏度,以及(3)聚腺嘌呤(poly-A)的表面涂层,用于减少非特异性吸附和生物污染(图1)。这些成分的独特组合使该方法能够以SIAO方式对未稀释的人血浆样品进行蛋白质分析,而无需进行样品处理。
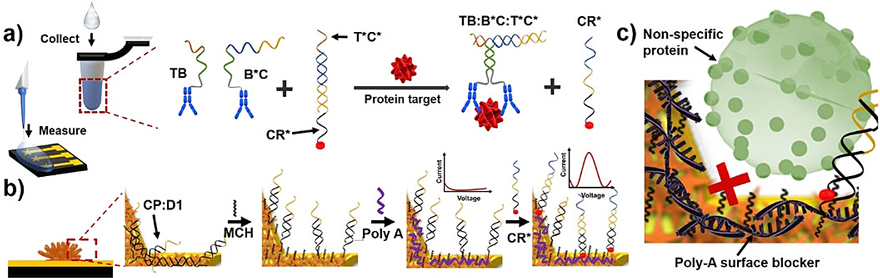
图1. e-biobarcode用于蛋白检测的工作原理示意图。
为了验证设计的生物条形码方法,作者首先使用链霉亲和素作为模型蛋白质进行实时荧光测定,验证蛋白质结合引发条形码DNA链的释放。使用分别在TB和B*C DNA的5'和3'末端修饰的生物素捕获链霉亲和素。TB和B*C包含一个六碱基对的互补区(图2a中的绿色域),该互补区在室温下不形成稳定的双链体。在识别同一个链霉亲和素分子之后,其可通过六碱基对的互补结合形成DNA/蛋白质复合物(图2a)。之后,该复合物的toehold区域可以与T*C*:CR*双链结合,发生链置换反应,释放CR*。之后CR*与DNA双链探针CP(荧光标记):D1(淬灭标记)结合,释放D1链,产生荧光信号。使用该设计,在0分钟时,测得的信噪比为13.5(图2b),这表明该方法稳定、快速,几乎不受未结合的生物识别元件的干扰。
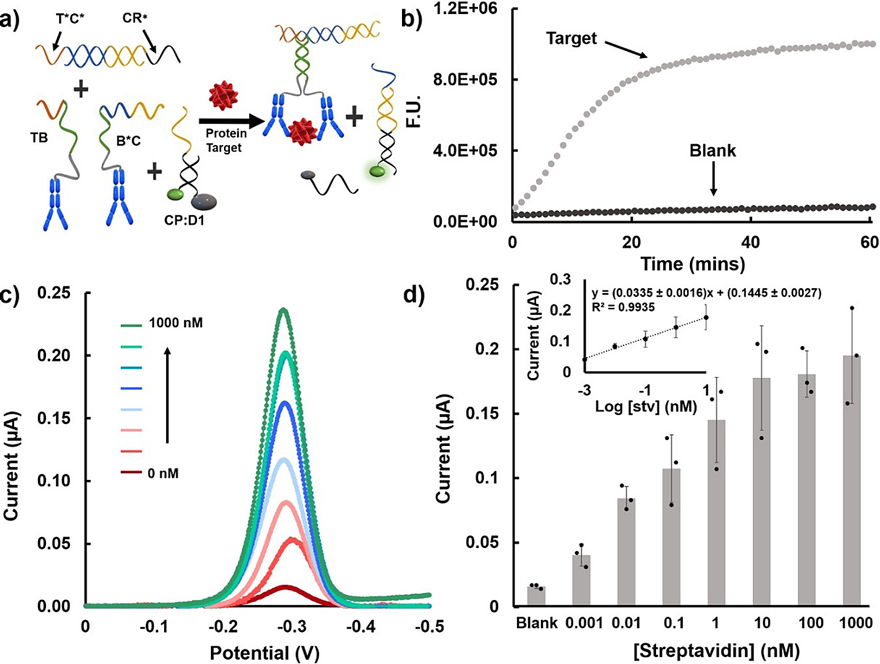
图2. 使用链霉亲和素-生物素作为模型体系进行biobarcode验证。
在使用荧光法证明该设计的合理性之后,作者随后将其与电化学检测方法结合。他们的电化学测定法是在溶液中捕获蛋白质,然后在电极表面对释放的条形码进行杂交。这种设计使蛋白质捕获的最关键步骤发生在溶液中,从而避免了基于表面的抗体/蛋白质结合中遇到的扩散和空间位阻限制。
作者通过将捕获探针(CP:D1复合物)固定在电极表面上,消除了荧光测定中所需的淬灭剂和荧光团,并用电化学报告分子亚甲基蓝(MB)标记CR*。用于电化学信号转导的3D纳米结构金电极通过三个分子层功能化,这些分子层旨在捕获所需靶标(捕获探针,CP:D1)并排斥生物背景(巯基己醇(MCH)和poly-A)。通过上述设计,他们建立了一个SIAO系统,将样品加入装有反应混合物的样品瓶内,之后取一滴溶液加在电化学芯片上进行电化学测量(图1a)。在存在目标分析物的情况下,释放的条形码CR *与固定的捕获探针杂交并置换D1,从而使MB部分靠近电极表面,从而产生电化学信号(图1a-b)。为了验证e-biobarcode assay的可行性,作者建立了以链霉亲和素为靶标和平面金为电化学传感器的体系。随着链霉亲和素浓度的增加,MB还原所产生的电流也逐渐增加(图2c)。该传感器在1 pM-10 nM浓度范围内表现出对数线性响应,检出限(LOD)为208 fM(图2d)。由于临床样品中生物标志物的含量较低,因此灵敏检测对于生物传感器至关重要。亚pM 的LOD也证明了本方法可以作为超灵敏蛋白质检测的平台。
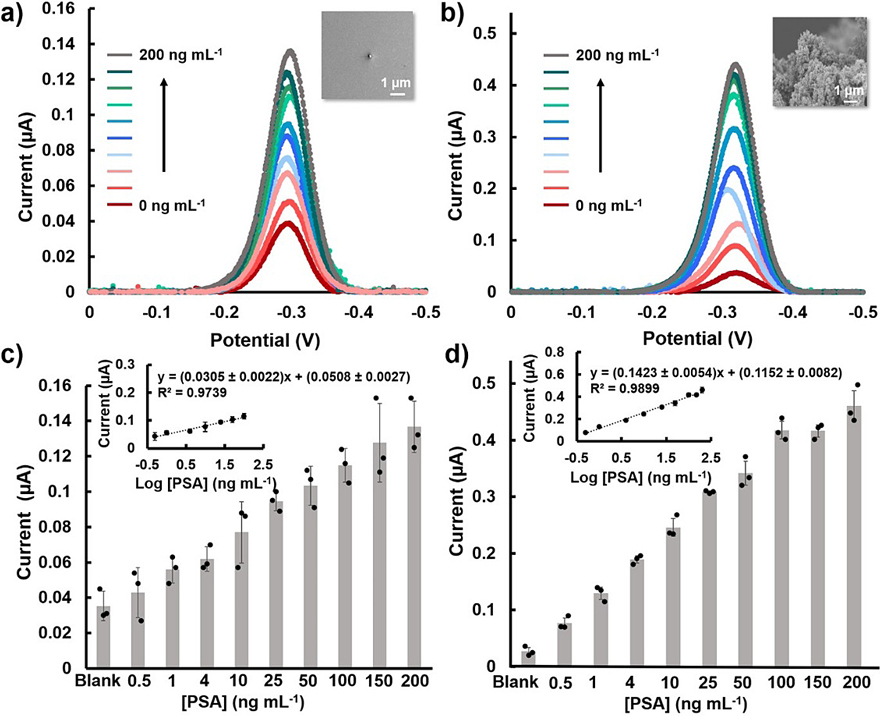
图3. 使用e-biobarcode方法检测PSA的分析性能评估。
为了证明传感器在检测相关癌症蛋白生物标志物中的适用性,使用前列腺素特异性抗原(PSA)作为靶蛋白,并使用生物素/链霉亲和素相互作用将多克隆抗PSA抗体与TB和B*C结合。在与PSA结合之后,形成DNA-抗体/蛋白复合物并启动链置换反应,释放MB标记的CR*链,引发电化学信号。在平面金电极上测得的电化学电流随PSA浓度的增加而增加(图3a)。在0.5至100 ng•mL-1的对数线性范围内分析PSA,LOD为2 ng•mL-1(图3c)。在临床应用中,PSA浓度高于4 ng•mL-1的阈值水平即可指示前列腺癌。尽管获得的LOD低于此临床相关阈值,但作者仍试图重新设计以进一步增强其LOD值,实现更强大和可靠的传感性能。
与二维感应电极相比,由纳米结构构件的组装产生的三维电极允许将更多数量的生物识别探针沉积在电极表面上,在目标捕获方面具有更合适的方向和间距。作者创建了带有尖锐边缘的星形金电极,并使用三维纳米结构的电极进行了上述实验。他们将3D纳米电极与平面电极的性能进行了比较(图3c-d)。3D纳米电极的实验结果表明,在对数线性范围0.5 ng•mL-1-200 ng•mL-1范围内进行PSA分析,其灵敏度为0.14μA/ log(ng•mL-1)和LOD为0.3 ng•mL-1。与平面电极相比,使用3D纳米电极可显着提高灵敏度(四倍)和LOD(六倍),说明使用3D纳米电极进行e-biobarcode assay为更适合临床分析的分析方法。
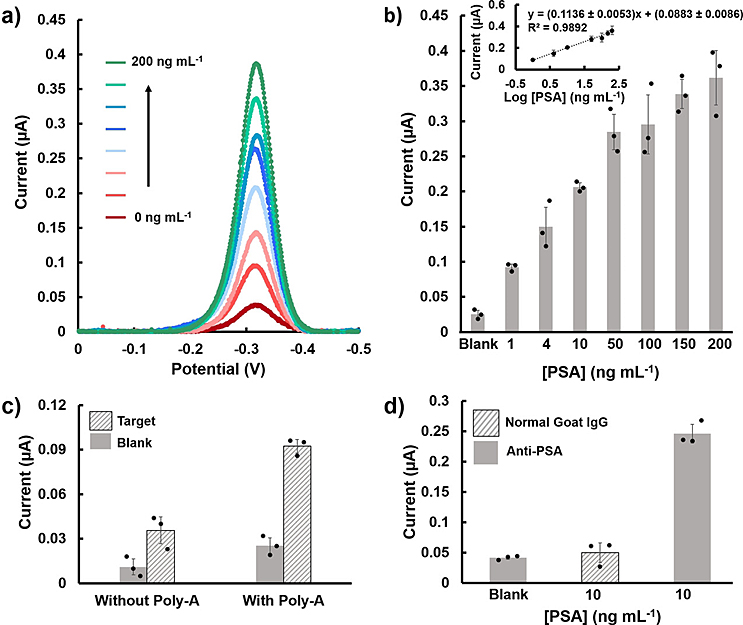
图4. 使用e-biobarcode方法在存在生物干扰物质的情况下检测PSA的分析性能评估。
对于要用于临床分析和决策的生物传感器,它必须在复杂的液体(例如血清、血浆、血液或尿液)中成功运行。这些液体由蛋白质和其他可降解测定试剂和/或其他大分子的大分子组成。这些大分子还可能非特异性地吸附到电极表面上并影响传感器的性能。为了避免这些影响,需要使用表面阻断剂如牛血清白蛋白(BSA)等。在作者的方法中,利用DNA和金的腺嘌呤碱基之间的强亲和力使用了poly-A链进行表面处理,以减少可用于非特异性吸附干扰生物分子的未反应电极的表面积。而且,与用作表面阻滞剂的庞大蛋白质不同,poly-A链的尺寸较小不会干扰电子传输或捕获探针和报告探针的杂交,同时减少了非特异性吸附的负面影响。
为了评估这种结合了poly-A作为表面阻滞剂的方法是否适合临床使用,作者对在未稀释人血浆中掺有PSA的样品进行了检测。与之前的结果类似,尽管信号强度较缓冲液中测得的值低,但灵敏度仍然很高,LOD为0.4 ng•mL-1,对数浓度从1 ng•mL-1至200 ng•mL-1呈线性范围(图4b)。作者也验证了poly-A在维持信噪比从而提高测定灵敏度和LOD方面发挥了重要作用(图4c)。
为了进一步证明该放大的特异性,作者使用正常的山羊IgG对照抗体代替抗PSA抗体进行检测。与非特异性正常山羊IgG抗体相比,抗PSA抗体的电流增加更大(图4d)。此外,他们还使用非特异性蛋白质IL-6和GFAP进行测试,同样,仅当PSA与特异性抗体一起存在于溶液中时,才观察到统计学上显着的信号增加。这些结果证实了该方法对真实人类样品的特异性和敏感性,并证明了在临床应用中的潜在用途。
总结与展望
作者将生物条形码技术与电化学检测结合,实现了以sample-in-answer-out的方式在未稀释的血浆中检测癌症标志物,并具有临床决策所需的分析灵敏度和特异性。重要的是,这种分析无需依次添加试剂或进行多步处理,适用于需在现场做出临床决策的场景。
本文第一作者Sarah Traynor,从本科开始在李峰课题组学习DNA纳米技术,目前在麦克马斯特大学攻读研究生,由李峰教授与Soleymani教授联合培养。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Dynamic Bio-Barcode Assay Enables Electrochemical Detection of a Cancer Biomarker in Undiluted Human Plasma: A Sample-In-Answer-Out Approach
Sarah M. Traynor, Guan A. Wang, Richa Pandey, Feng Li, Leyla Soleymani
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202009664
李峰课题组
Leyla Soleymani课题组
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号