湖南大学王柯敏、黄晋团队Angew:内源性高丰度mRNA驱动的纳米机器用于细胞内低丰度miRNA成像
可视化检测活细胞中低含量的生物分子在分子生物学和疾病诊断方面具有非常重要的意义。此类探针不仅需要能够自主穿过细胞膜屏障,并且在细胞环境中保持稳定。基于金纳米颗粒构建的纳米耀斑探针(Nanoflare)是此类探针的典范。为了改善该探针的精确度,王柯敏团队在2015年发展了一种基于荧光共振能量转移的纳米耀斑探针(FRET Nanoflare),不仅消除了假阳性信号,而且最大程度降低了系统误差带来的干扰(JACS, 2015, 137, 8340; Anal. Chem., 2015, 87, 8724)。但是该探针仍局限于“一对一”信号触发模式(一个靶标触发一个信号),用于成像活细胞内某些低丰度靶标可能会导致检测灵敏度不足等问题。因此迫切需要开发有效的“一对多”模式(一个靶标触发多个信号)用于灵敏成像活细胞中低丰度靶标。
近日,湖南大学王柯敏(点击查看介绍)和黄晋(点击查看介绍)团队在化学顶级期刊Angew. Chem. Int. Ed.上发表研究论文,报道了一种放大的基于荧光共振能量转移的纳米耀斑探针(Amplified FRET Nanoflare):利用细胞内高丰度内源性mRNA作为燃料分子驱动纳米机器在活细胞内自动运行,从而实现细胞内低丰度miRNA的放大成像(图1)。该探针可以有效地避免外加物对反应体系的破坏,同时简化操作过程。除此之外,该设计以荧光共振能量转移(FRET)为比率型输出信号有效地降低了由于系统波动或者化学干扰带来的假阳性信号,同时由于高丰度mRNA的参与,无论是在试管中还是在细胞内对特定miRNA的检测都表现出很高的灵敏度和特异性以及在复杂环境中的抗干扰能力。该论文第一作者为博士生李静,通讯作者为黄晋教授和王柯敏教授。
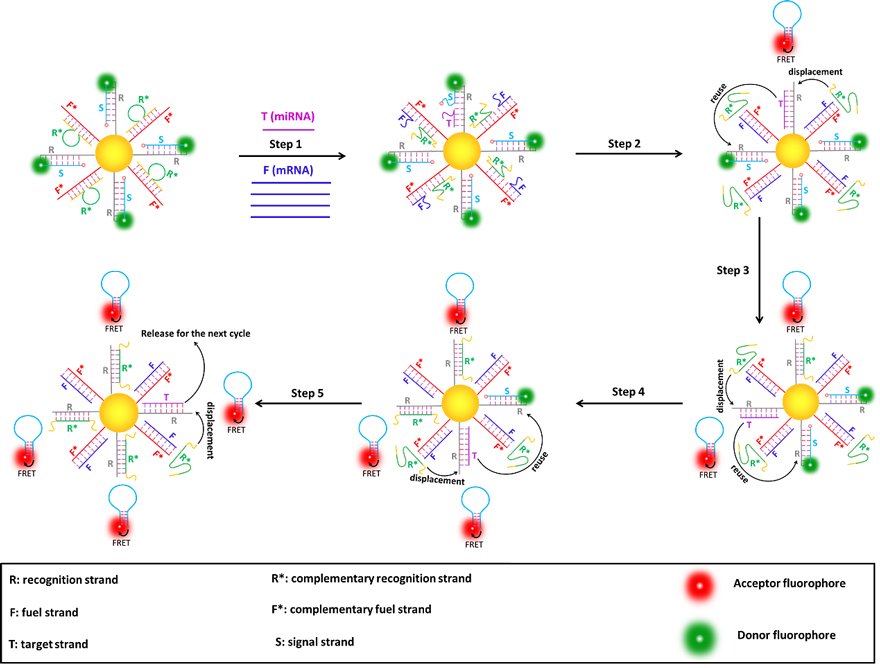
图1. miRNA触发、mRNA驱动放大的FRET纳米耀斑探针的工作机理。在最初状态下,两种DNA双链(R/S和F*/R*)组装在金纳米颗粒的表面上,在S的5'和3'末端分别标记上荧光供体(Cy3)和荧光受体(Cy5),与S杂交的R能够识别T(miRNA),中间环部设计的R*与F*杂交同时可以识别F(mRNA)。第一步:在少量的T(miRNA)和大量的F(mRNA)同时存在时,两者分别识别R和F* ,通过链置换反应逐渐的置换S和R*。第二步:置换下来的S远离金纳米颗粒的表面并形成一个稳定的发夹结构,导致Cy3和Cy5靠近,发生FRET。此时一个靶标只能产生一个信号,为了实现“一个靶标产生多个信号”,需借助内源性mRNA作为燃料分子(F)驱动纳米机器的运行。第三步:释放的R*与R杂交,置换出T可以重复利用去释放多个发夹S。第四步和第五步:与第三步类似,R*依次地置换出T,T重复使用去释放更多的发夹S产生FRET信号。总之,T作为催化链在燃料链F的辅助下反复的触发发夹S从金纳米颗粒上解组装,产生显著放大的FRET信号。在最终状态下,金纳米颗粒上保留两种新类型的DNA双链(R/R*和F*/F)。
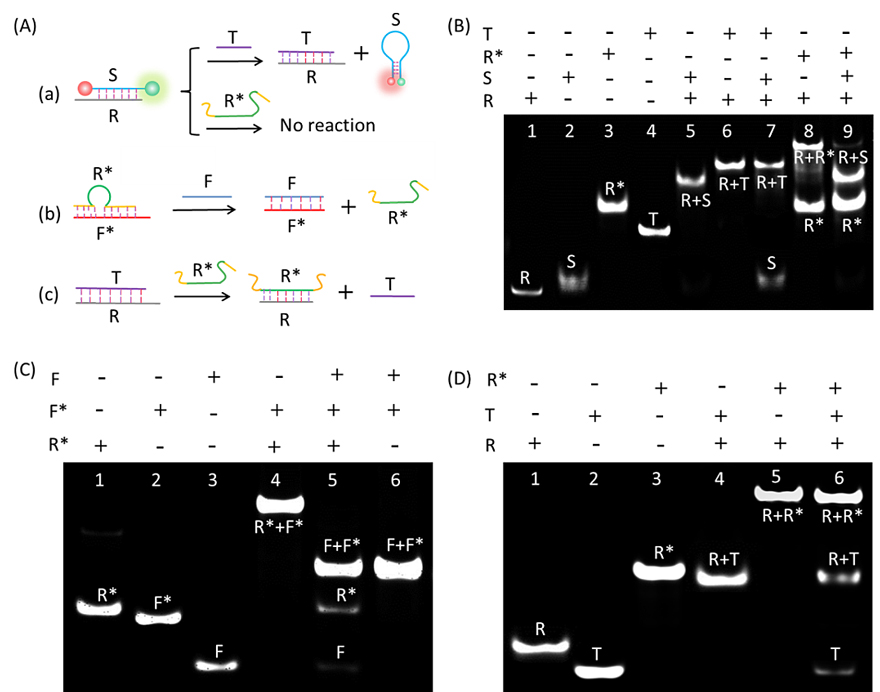
图2. 电泳分步验证T触发、F驱动的放大纳米耀斑的可行性。(A)每一步放大FRET纳米耀斑的反应示意图,字母所代表的含义与原理图中一致,(a)T识别S/R双链中的R逐渐释放T通过链置换反应,相应的实验验证如图(B):泳道1-4分别代表R、S、R*和T;泳道5:反应物R/S杂交双链;泳道6:产物链R/T杂交双链作为反应后的对照条带。在泳道7中,当向R/S杂交双链中加入T,结果产生了两个新的条带(R/T和S)并且R/S几乎完全消失。结果表明:T可以识别R且释放出S。有意思的是,当把R*加入到R/S杂交双链中(泳道9),并没有产生新的条带R/R*(泳道8:产物R/R*作为对照条带)。结果也表明:在没有T的情况下,R*是不能释放S的。(b)F识别R*/F*杂交双链中的F*,释放出R*,结果验证如图(C):泳道1-3分别代表R*、F*和F;泳道4是反应物R*/F*杂交双链。在泳道5中,当向R*/F*反应物中加入F时,R*/F*完全消失,产生了F/F*和R*;泳道6:产物F/F*双链,作为对照条带。结果表明F可以识别R*/F*中的F*去释放R*。(c)R*可以与R/T中的R杂交,从而释放出T使其循环。相应的验证结果如图(D):泳道1-3分别代表R、T和R*,泳道4:反应物R/T杂交双链;泳道5:产物条带R/R*作为反应后的对照条带。在泳道6中,当向反应物R/T中加入R*后,产生了新的条带R/R*以及T条带,说明R*可以释放R/T中的T使其重复使用。
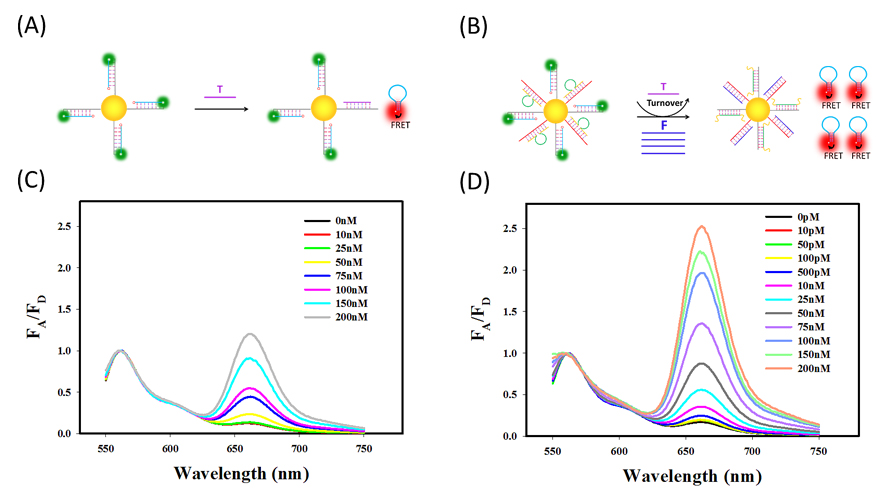
图3. 荧光考查T触发、F驱动的放大FRET纳米耀斑的放大性能。(A)FRET 纳米耀斑的反应示意图。(B)放大的FRET纳米耀斑的反应示意图。(C)FRET纳米耀斑的荧光变化谱图(归一化)随着不同浓度的T变化。(D)在F(mRNA)的辅助下,放大FRET纳米耀斑的荧光变化谱图(归一化)随着不同浓度的T变化。FA/FD代表FRET效率是指受体荧光强度与供体荧光强度的比值。结果表明:随着T浓度的不断增加,FRET纳米耀斑和放大的FRET纳米耀斑的荧光响应谱图也逐渐增加,但是在相同T浓度下,放大FRET纳米耀斑的FRET信号更强,能检测到更低的靶标范围,这是FRET纳米耀斑所检测不到的。

图4. 共聚焦成像T触发、F驱动的放大FRET纳米耀斑在细胞内的分布情况以及成像时间考查。(A)通过溶酶体共定位分析放大FRET纳米耀斑与细胞孵育6 h后在细胞内的分布情况,通过计算得出绿色和红色的皮尔逊相关系数为0.94,而绿色和蓝色之间的皮尔逊相关系数仅有0.45,说明6 h以后大部分的放大FRET纳米耀斑能够有效的从溶酶体中逃逸出来进入细胞质中。(B)不同孵育时间下,MCF-7细胞内共聚焦荧光成像变化图。成像结果表明:随着孵育时间的增加细胞内的FRET信号先逐渐增加然后缓慢的降低,在6 h时达到最大。标尺:20 μm。
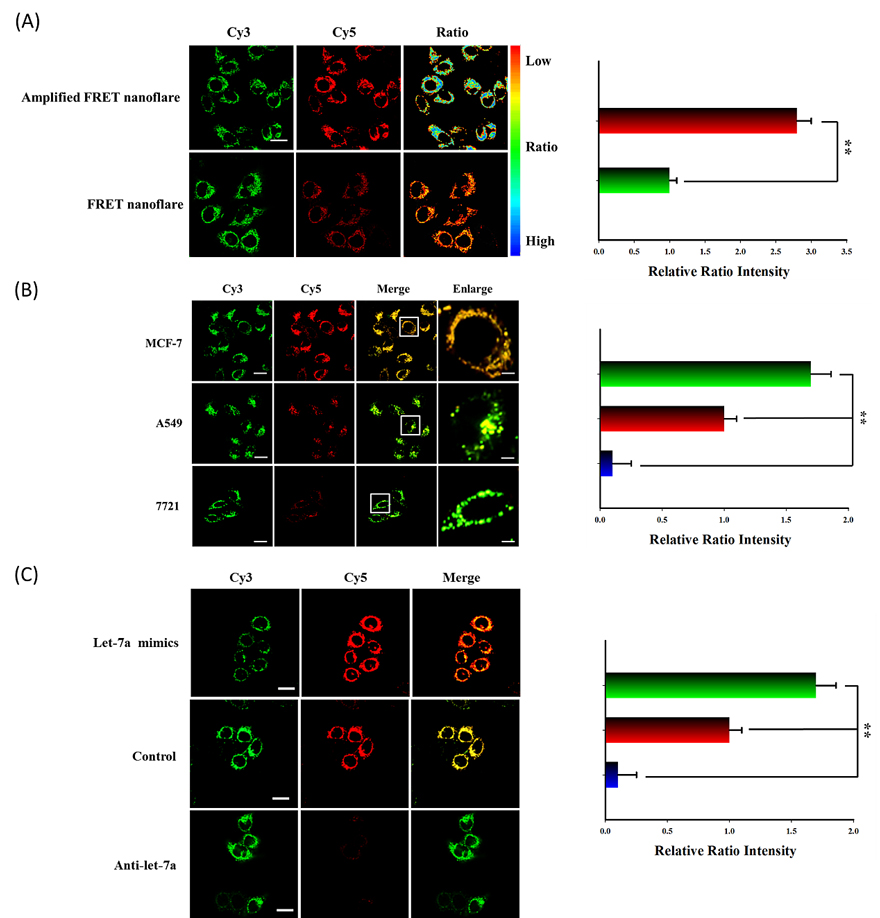
图5. 共聚焦荧光成像细胞内放大FRET纳米耀斑。(A)放大FRET纳米耀斑和FRET纳米耀斑在MCF-7细胞中对靶标成像结果比较图。结果表明:在相同的条件下,放大的FRET纳米耀斑在MCF-7细胞中产生更高的FRET的信号,原因是在内源性F(mRNA)的辅助下,能够产生一系列的链置换反应使靶标T循环,实现信号放大。在试管中和在细胞中都清楚的表明放大的FRET纳米耀斑确实能够增加miRNA检测的灵敏度,这对于检测痕量特定miRNA是非常重要的。(B) 放大FRET纳米耀斑在不同细胞系中的共聚焦荧光成像图。成像结果表明:目标miRNA let-7a在上述三种细胞中的表达水平从高到底依次是MCF-7>A-549>7721其结果与RT-qPCR结果一致。(C)放大FRET纳米耀斑区别MCF-7细胞中目标miRNA的变化情况。通过脂质体转染技术事先将let-7a mimics和anti-let-7a分别转染到MCF-7细胞中用于增加和降低目标miRNA在细胞中的表达水平,其中不做任何处理的MCF-7细胞作为对照组,随后分别与放大FRET纳米耀斑进行孵育。成像结果表明:与对照组相比,转染let-7a mimics组中FRET信号明显增强,而转染anti-let-7a组的FRET信号显著降低,说明放大FRET纳米耀斑能够区别细胞内miRNA的变化情况。右边的柱状图代表相应的归一化后的比率强度值。标尺:20 μm。
综上所述,该纳米机器可以借助内源性mRNA的驱动在活细胞内自动运行不需要外加辅助物即可实现对特定miRNA的放大成像。与不放大的同类型探针相比,其灵敏度降低了三个数量级。可以展望,如果将细胞内或血管中不同的高丰度分子作为燃料分子,借助于与之相对应的识别分子,我们可以设计不同功能的纳米机器在活细胞或者血管中去执行不同的任务。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Amplified FRET Nanoflare: An Endogenous mRNA-Powered Nanomachine for Intracellular MicroRNA Imaging
Jing Li, Jiaoli Wang, Shiyuan Liu, Nuli Xie, Ke Quan, Yanjing Yang, Xiaohai Yang, Jin Huang*, Kemin Wang*
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202008245
导师介绍
王柯敏
https://www.x-mol.com/university/faculty/10117
黄晋
https://www.x-mol.com/university/faculty/66377
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号