Nat Genet:遗传分析助力解析m⁶A贡献复杂疾病遗传力
N6-methyladenosine (m⁶A) 修饰是信使RNA上丰度最高的修饰。自2011年芝加哥大学何川实验室发表的一系列开创性研究以来,m⁶A吸引了学术界广泛关注和海量的研究。通常认为m⁶A通过特异性识别蛋白(reader proteins)介导影响RNA命运(例如剪切、核质运输、翻译、降解等)[1]。过去的研究中通过敲除/敲降m⁶A通路上的writer、eraser以及reader,大量m⁶A调控和影响的生物学过程被发现和报道,包括:生长发育、应对环境刺激、癌症等 [2]。这些研究为我们了解m⁶A介导的基因调控做出了重要贡献。但值得注意的是,用基因敲降的手段扰动m⁶A有时很难区分观察到的变化是由于初始效应还是次生效应。全基因组数量性状定位(Quantitative trait loci (QTL) mapping)是一种从遗传差异的角度研究基因调控的方法 [3];这一方法是基于大自然在基因组上做的天然实验,让我们可以没有偏见的观测m⁶A变化和翻译效率变化的关联性,从而探究m⁶A究竟是否调控翻译效率这一问题。同时,基于QTL mapping的分析也能探究遗传序列如何影响人群中不同个体之间m⁶A水平的差异,以及m⁶A在非经典孟德尔遗传的复杂疾病中有何贡献,并帮助我们解答复杂疾病全基因组关联分析(GWAS)定位到的遗传位点的作用机理 [4]。
近日,芝加哥大学遗传和系统生物学系博士生张子杰和罗凯旋博士在何川教授、贺信教授和统计遗传学家Matthew Stephens指导下在Nature Genetics杂志上发表文章“Genetic analyses support the contribution of mRNA N6-methyladenosine (m⁶A) modification to human disease heritability”,对m⁶A在人群中的遗传多样性及m⁶A在基因调控和复杂疾病中的作用进行了解析。
作者利用“1000 Genomes Project”中研究最为广泛的一组Yoruba Lymphoblastoid cell lines (LCLs),定位了一组cis-m⁶A QTLs(图1a),也就是单核苷酸多态性(SNPs)中和m⁶A水平相关联的遗传位点(图1b)。这组LCLs被广泛用于regulatory QTL 研究中,积累了包括expression、decay、ribosome loading、protein level 等分子性状的QTL数据 [5]。作者联合分析了在这组LCLs中定位的m⁶A QTLs以及前人积累的其他QTL,探究了m⁶A究竟是否调控诸如翻译效率等分子性状的问题。与敲除/降m⁶A writer或eraser的研究方法不同的是,m⁶A QTLs可以看作是大自然做的实验,每一个m⁶A QTL一次只扰动一个cis m⁶A位点,而不是整个m⁶A methylome水平,从而可以提供一个全新的视角研究m⁶A调控机制。通过观察每个m⁶A-QTL对其他相关分子性状(例如翻译效率)的作用,可以研究在自然状态下m⁶A变化对相关分子性状的影响。
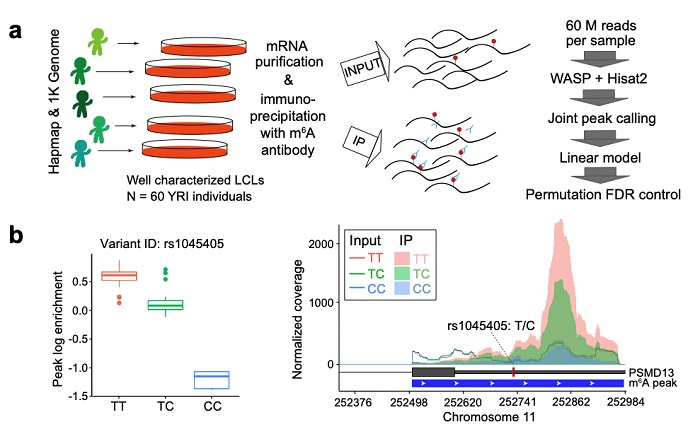
图1. m⁶A QTLs mapping实验设计及示例
基于m⁶A QTLs的分析,作者发现m⁶A QTLs富集于m⁶A peak内的RRACH motif、RNA 结合蛋白结合位点(RBP binding sites)、RNA二级结构多样性位点(RiboSNitches)以及包含转录因子结合位点(TF binding site)、组蛋白修饰(histone modifications)的转录调控功能区(图2);这提示m⁶A QTL的机制可能是遗传差异(SNPs)通过扰动m⁶A motif、RNA结合蛋白的结合、RNA二级结构、转录因子结合以及组蛋白修饰进而影响m⁶A 水平,揭示了上游参与调控m⁶A水平的多种机制。另外作者联合分析了m⁶A QTLs以及APA、expression、decay、ribosome loading及蛋白水平的QTL(图3a),发现SNPs对m⁶A和对其他分子性状(例如代表翻译效率的ribosome loading)的效应值(effect size)是正相关和负相关对称分布的(图3b)。也就是说一部分关联着m⁶A上调的遗传多样性位点,关联着ribosome loading的上调,而另一部分则关联着ribosome loading的下调。这个结果揭示了一种可能性:m⁶A对于翻译效率的调控是多样的,这补充了过去文献中仅仅关注m⁶A促进翻译的简单模型。作者还发现不同的RNA结合蛋白在m⁶A位点附近的结合,可部分解释m⁶A对下游分子性状影响的多样和异质性。
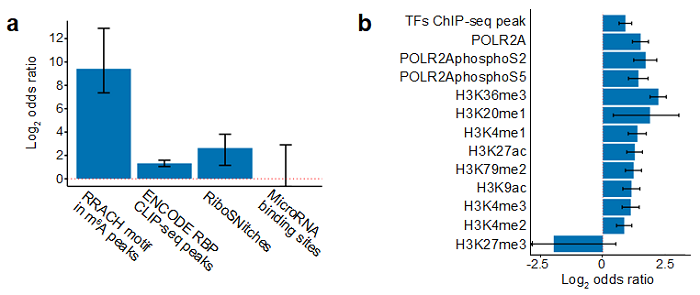
图2. m⁶A QTLs在RNA和转录特征功能区的富集
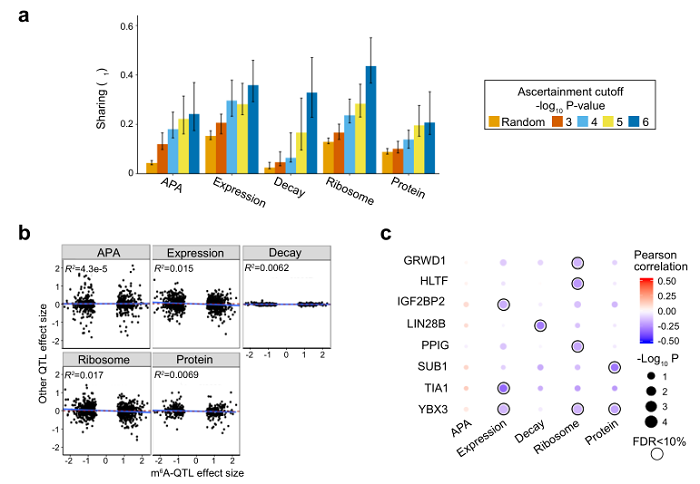
图3. 多种分子性状QTLs联合分析揭示m⁶A翻译效率调控的机理
此外,作者联合m⁶A QTLs数据分析了45组复杂性状(疾病)的GWAS数据并发现m⁶A QTLs高度富集了GWAS信号(图4a)。作者采用Stratified LD score regression (S-LDSC)检验了精确定位(fine-mapping)的m⁶A QTLs 的posterior inclusion probability在GWAS性状中的遗传力(heritability)富集度并发现m⁶A QTLs中10-20倍地富集了几种血液及免疫相关疾病的遗传力(图4b-c);这些疾病符合该研究所使用源自B淋巴细胞的LCLs的组织特异性。同时,根据S-LDSC 估算,m⁶A QTLs在这些性状中解释了2-4%的遗传力,这与splicing QTL(sQTL)所能解释的遗传力相当,大约是expression QTL(eQTL)所能解释的遗传力的一半(图4d)。基于遗传学领域已建立的对eQTL和sQTL在复杂性状遗传中有突出作用的共识,m⁶A与eQTL、sQTL的比较首次证明了m⁶A 修饰对复杂性状的遗传也有相当的贡献。为了进一步展示如何利用m⁶A QTLs理解复杂性状GWAS位点的作用机理,作者用TWAS/FUSION软件结合m⁶A QTLs数据拟合了基因型到m⁶A水平的预测模型,并以此运用到GWAS数据中开展了transcriptome-wide association study(TWAS)分析。该分析在多数性状中找到了几个到数十个和复杂性状相关联的m⁶A peaks/genes(图5a);且这些gene与expression-TWAS和splicing-TWAS找到的gene重合度较低(图5b),说明m⁶A代表着一条不同于expression和splicing的从遗传差异到复杂性状差异的传导路径。
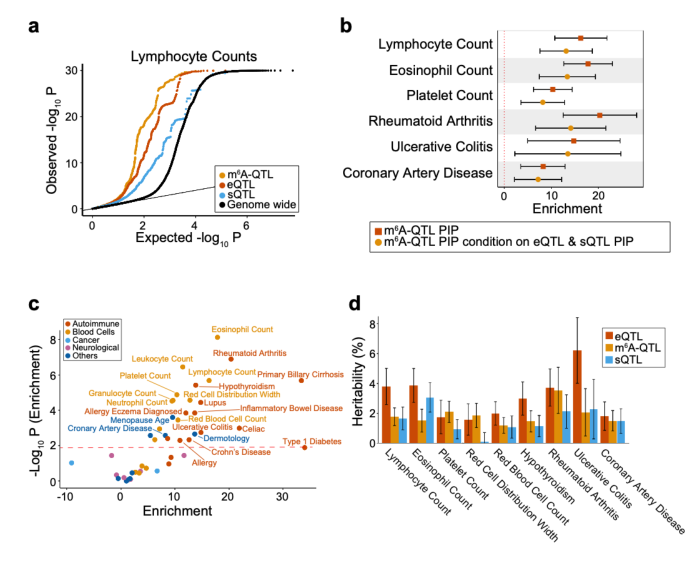
图4. m⁶A QTLs 对复杂疾病heritability的贡献
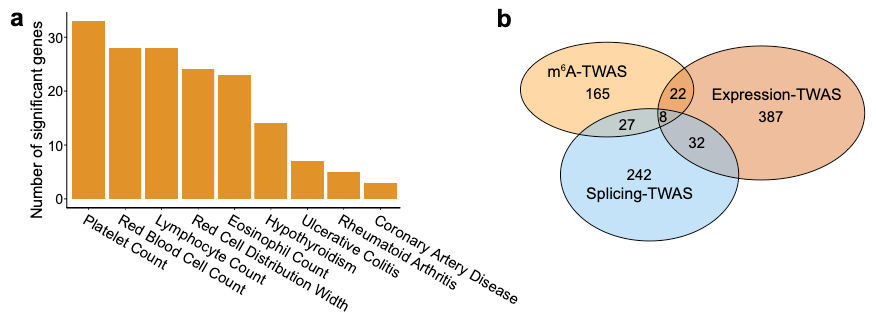
图5. 以m⁶A为分子性状的Transcriptome-wide association study
原文:
https://www.nature.com/articles/s41588-020-0644-z
Genetic analyses support the contribution of mRNA N6-methyladenosine (m⁶A) modification to human disease heritability
Zijie Zhang, Kaixuan Luo, Zhongyu Zou, Maguanyun Qiu, Jiakun Tian, Laura Sieh, Hailing Shi, Yuxin Zou, Gao Wang, Jean Morrison, Allen C. Zhu, Min Qiao, Zhongshan Li, Matthew Stephens, Xin He, Chuan He
Nat. Genet., 2020, DOI: 10.1038/s41588-020-0644-z
X-MOL导师介绍:
何川
https://www.x-mol.com/university/faculty/1436
贺信
https://www.x-mol.com/university/faculty/222157
Matthew Stephens
https://www.x-mol.com/university/faculty/222158
科研思路分析
Q:这项研究是如何酝酿的?
A:一方面近年来,随着“1000 Genomes Project”积累的全基因组遗传变异数据及其相关细胞系和以高通量测序技术为基础的各种组学技术的普及应用,研究人员展开了大量分子性状QTL的研究以图解析从DNA序列到蛋白产物的基因表达调控过程。这些研究帮助我们了解遗传差异如何影响基因调控过程以及其中的机理。例如联合分析从chromatin state到expression的一系列QTLs发现在一部分从chromatin state、histone modification到pol2 binding再到下游gene expression协从的变化都能追溯到TF binding affinity的变化;提示了在一些情况下,转录因子的结合发动引导了基因调控的一系列程序。另外,过去十多年积累了大量的GWAS数据,并且发现大量GWAS 信号都在非编码区。Regulatory QTLs,特别是eQTLs,被广泛用于理解和解释GWAS中遗传差异到表型差异的机理。
另一方面m⁶A作为新兴的转录后调控机制近年来收到了广泛的关注,但仍有许多未解之谜。例如我们尚不清楚转录组上众多的adenosine site,m⁶A甲基化位点是如何被决定的、m⁶A有众多的方式影响RNA命运,但RNA序列如何影响m⁶A的功能我们不得而知。另外,m⁶A虽然被报道在癌症中有重要作用,但m⁶A是否对复杂疾病有贡献还尚无报道。
结合上述两个方面的背景,我们自然而然想到了填补m⁶A QTL研究的空白。
Q:这项研究有什么重要意义?
A:本研究首次利用自然遗传变异作为扰动,研究了m⁶A差异以及和相关分子性状的关系。这种方法相较于传统分子生物学方法的好处是我们能观察到没有偏见的结果。虽然本文受限于样品数量和统计功效,只是部分解答了m⁶A variation上下游通路的调控机理;但该文章所搭建的研究方法可被用于更大的样品库或不同的组织/细胞上,获得更加丰富的数据和结论。同时,本文首次评估了m⁶A差异对于复杂疾病的贡献,为解析复杂疾病提供了新的机理。联合分析m⁶A QTL和GWAS数据能帮助我们定位一部分由m⁶A介导的复杂疾病的致病基因,为寻找新的疾病干预提供新的潜在靶点。
参考文献:
1. Roundtree, I.A., Evans, M.E., Pan, T. & He, C. Dynamic RNA Modifications in Gene Expression Regulation. Cell 169, 1187-1200 (2017).
2. Frye, M., Harada, B.T., Behm, M. & He, C. RNA modifications modulate gene expression during development. Science 361, 1346 (2018).
3. Albert, F.W. & Kruglyak, L. The role of regulatory variation in complex traits and disease. Nature Reviews Genetics 16, 197-212 (2015).
4. Neumeyer, S., Hemani, G. & Zeggini, E. Strengthening Causal Inference for Complex Disease Using Molecular Quantitative Trait Loci. Trends in Molecular Medicine 26, 232-241 (2020).
5. Li, Y.I. et al. RNA splicing is a primary link between genetic variation and disease. Science 352, 600-604 (2016).
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号