FLASH PCR:一个新型可视化核酸快检平台
核酸检测(nucleic acid tests, NATs)能够从微量的遗传物质中获得大量的分子信息,因此在疾病诊断和监测领域具有不可或缺的地位。其中,借助于大量的样本操作和昂贵仪器的聚合酶链式反应(polymerase chain reaction, PCR)是目前集中式临床实验室主要的核酸检测方法。然而针对目前个体化医疗的发展,在患者床边或即时检测(point-of-care testing, POCT)逐渐成为发展趋势。同时,在广泛传播的感染可造成严重发病率甚至死亡的中、低收入国家,开发可现场诊断的标准NATs对于监测和管理病毒、细菌以及寄生虫感染来说至关重要。因此将PCR等NATs小型化为可便携、低成本的检测平台是目前疾病诊断、监测领域的热点研究之一。对于便携式NATs本身而言,比色信号是一种理想的信号输出方式,但是目前开发简便、可定量且通用的颜色读出器依旧有很高的需要。故而,开发成本低廉、设计简单的用户友好型定量比色检测平台对于即时诊断以及资源有限地区疾病诊断至关重要。
近期,四川大学李峰(点击查看介绍)课题组与吴鹏(点击查看介绍)课题组合作,报道了一种使用DNA嵌入染料(DNA intercalating dyes, DIDs)进行比色核酸检测和定量的方法,作者将之命名为FLASH(Fast Light-Activated Substrate cHromogenic,快速光激活底物显色技术,图1)。DIDs是核酸染色和定量PCR(qPCR)等标准NATs的通用染料,现有的测试主要利用其嵌入DNA后的荧光增强特性。该团队之前的研究发现:染料嵌入DNA后也能产生单线态氧(1O2,图2a)[1],从而使传统的荧光DIDs转换成type-II型光敏剂。利用这一原理,FLASH技术可快速光氧化显色底物,产生比色信号读出。而且通过与PCR集成,成功将基于DID参与的荧光PCR转化为比色PCR。为了更适用于POC以及现场诊断,他们继续开发了两种读出平台:便携式FLASH设备和纸基FLISH测试条,展现出FLISH PCR良好的临床应用潜力(图1)。
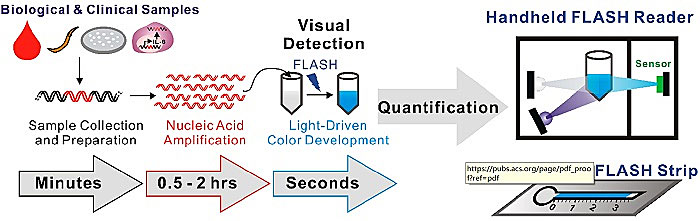
图1. 使用FLISH系统可视化、比色检测和/或定量不同生物和临床样本中遗传生物标志物的工作流程。就诊断检测流程而言,首先通过PCR或等温扩增提取DNA或RNA,继而利用FLISA系统检测。通过溶液颜色由无色变为蓝色来进行相应靶标核酸的检测。最后,可通过手持式电子FLISA信号读出装置或纸基FLISA测试条在point-of-care场所定量检测。
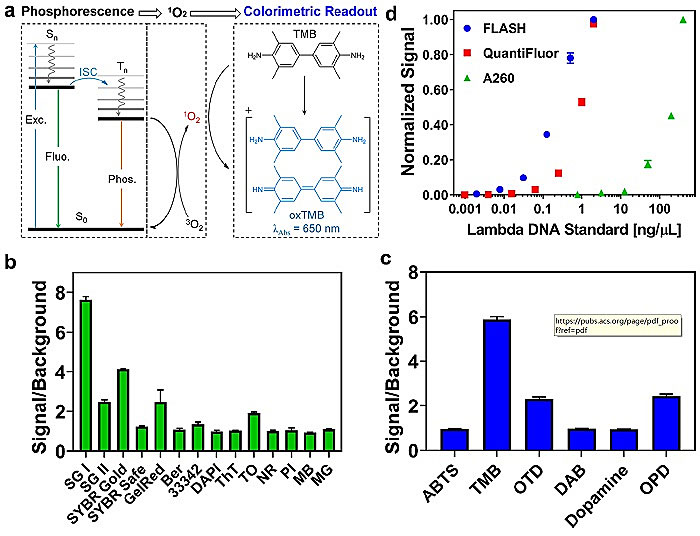
图2. 方法原理和优化。a. FLASH反应中光敏过程的机理示意图。b. 基于光催化检测PCR扩增子的信噪比筛选14种DNA嵌入染料。其中,比色信号通过分析模拟PCR扩增子的10 nM dsDNA得到,背景则是通过分析模拟引物的10 nM ssDNA获得。c. 筛选常用的显色底物来优化ELISA系统的显色读出。d. 分别使用FLISA(蓝色)、dsDNA荧光定量试剂盒(红色)以及A260(绿色)检测Lambda DNA标准物的滴定曲线。
首先,为了使PCR的可视化、比色读出成为可能,作者期望在不降低分析性能的情况下将荧光DIDs转换成显色系统。为此,他们筛选了10种DIDs以及6种常用显色底物,对比方法信背比确定最佳组合:以SYBR Green I (SG-I) 为光敏剂(图2b),以3,3,5,5 -四甲基联苯胺(TMB)为显色底物(图2c)。在此条件基础上,进一步对比了该方法与传统基于荧光turn-on方法的检测能力,如图2d所示,其检出限可与荧光检测法相媲美(LOD:FLISH 2 pg/μL vs 荧光法 1 pg/μL),表明在未损失分析性能前提下FLASH有潜力取代荧光进行PCR的颜色读出。
进一步,作者将其作为信号读出系统与PCR结合,开发比色FLASH-PCR。以乙肝病毒(HBV-S)为目标,选择与之表面蛋白基因序列相对应的184 bps的合成DNA模板作为检测的靶标基因。通过系统优化FLASH-PCR的操作条件,包括光源设计、引物浓度、SG-I浓度、TMB浓度,以及PCR扩增子与FLASH试剂的预孵育时间。研究发现:FLASH-PCR的鲁棒性较好,在不同检测条件下性能都很稳健,且不需预孵育即可产生相应颜色变化。另外光驱动的颜色开发高效且易于控制,5 s的光照时间足以产生满足核酸定量的比色信号,仅需打开或关闭光源LED即可启动或终止颜色变化(图3b)。正如预期,FLASH-PCR的动态范围取决于PCR的循环次数(图3b),1 aM HBV-S模板(每个反应约10个拷贝数)在35个循环后可达到与qPCR相当的方法检出限。最后,进一步将FLASH系统相继与逆转录酶PCR、菌落PCR以及直接PCR相结合,证实其还适用于细胞、细菌和血清样本。

图3. FLISH PCR。a. 使用FLISH PCR分析临床或生物样本的工作流程示意图;b. 分别在不同光照时间(上图,35个循环)以及PCR循环数(下图,5s光照)条件下对拷贝数由6.0 – 6.0×106的合成DNA标准物进行FLISH PCR检测。
在对FLASH-PCR进行方法验证和优化之后,下一步面临的挑战是如何将实验转移至更能代表实际检测的条件下。为此,作者选择了具有代表性的一类临床疾病作为现场检测评估对象。土源性线虫(soil transmitted helminth, STH)感染是一类影响超过15亿人的全球健康问题,也是导致儿童营养不良和认知障碍的重要原因之一。然而经典的显微方法在临床诊断STH时灵敏度、特异性不够,而基于qPCR的NAT方法太过昂贵,无法在普遍贫困和资源缺乏的疾病流行性地区实施检测。因此他们的目标是将FLASH-PCR作为一种便携的qPCR替代方法进行STH感染的现场诊断和管理。
为了实现方法现场检测,PCR扩增以及FLISH技术都需要使用便携式平台。由于智能手机控制的便携式热循环仪已经商品化,所以作者专注于开发一种便携式电子信号读出装置(便携式FLASH快速显色设备),为PCR扩增子提供稳健、可靠的检测。自细节而言,FLASH信号读出装置集成了光照模块(一个高强度LED,λ = 490 nm)和颜色传感模块(图4a & 4b)通过在两模块间切换可实现现场原位检测光驱动颜色变化。通过3D打印将所有模块封装,并利用Arduino控制器以及开源代码进行操作。
作者选择β-微管蛋白上密码子200的基因片段(经过广泛验证的针对TT鉴别和耐药试验的基因标志物)相对应的164bp合成DNA标准物来评价所开发的便携式仪器FLASH-PCR的分析性能。利用智能手机控制的便携式热循环仪(miniPCRTM mini8)成功扩增不同浓度的合成DNA标准物,接着利用FLASH信号读出装置进行检测(图4c,顶部),基于此建立的标准曲线(1 min光照)与q-PCR灵敏度类似(图4c),证实该装置可成功进行定量检测,且性能可与商品化q-PCR相媲美。最后,为了验证该装置的现场检测能力,他们在儿童患病率超过50%的洪都拉斯农村地区选择适量接受过驱虫药治疗的学龄儿童,现场采集含有鞭虫(Trichuirs, TT)以及人蛔虫(Ascaris lumbrioides, AL)的寄生虫样本并提取基因组DNA,后转移至加拿大进行FLASH-PCR分析。利用该信号读出装置所得结果与显微镜检测定性以及PAGE凝胶分析结果非常一致(图4d),显示出他们的技术以及装置在现场疾病诊断、检测领域的应用潜力。
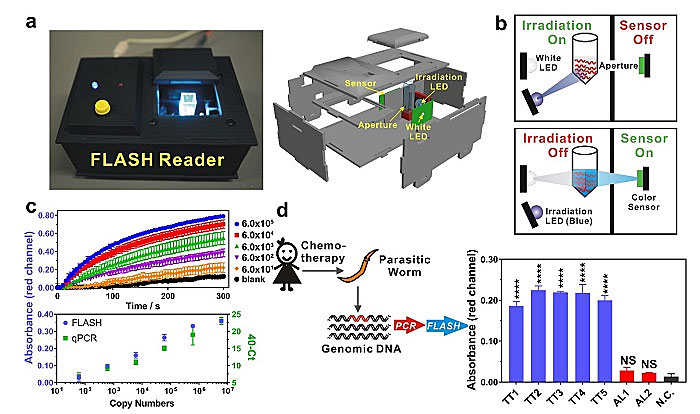
图4. 便携式FLISH信号读出装置检测STH感染。a. FLISH信号读出装置的完整组装图示(左)与关键单元图示(右)。b. FLISH信号读出装置工作原理示意图。c. 使用一定浓度梯度的DNA标准物产生的PCR扩增子进行FLISH信号读出装置性能评估。其定量能力与商品化的qPCR性能相当(下图)。d. 分析由洪都拉斯农村地区经化疗后的学龄儿童排出的鞭虫和人蛔虫等寄生蠕虫样本来评估FLISA信号读出装置的现场诊断价值。
为了进一步降低FLASH-PCR对仪器的需求,他们最终开发出使用距离作为信号读出方式的纸基FLASH测试条。该测试条采用蜡染工艺制作,利用疏水屏障创建清晰的圆形加样区和线性测试区(图S13)。之前的研究发现:SG-I会紧紧保留在加样区,只有在dsDNA存在下才能被洗脱到测试区 [2]。故而,在颜色显影测试区沉积一薄层TMB,可以将荧光转换为永久性的蓝色来作为距离读出依据(图5a)。因此,微量的核酸样本可以经过直接PCR扩增后,再利用FLASH测试条以无读出装置的方式进行检测(图5b)。图5c和5d为利用FLISH PCR直接分析未经稀释的人血清样本的HBV基因片段。其中,图5c中拷贝数为6.0 × 102的HBV基因片段(dM = 21 mm)在紫外灯下的迁移距离,可与空白样本明显区分(dM= 3 mm)。之后在光驱动下颜色变化1 min,测试区显影为蓝色,因此通过测试条的迁移距离可直观地读出检测结果(图5d)。
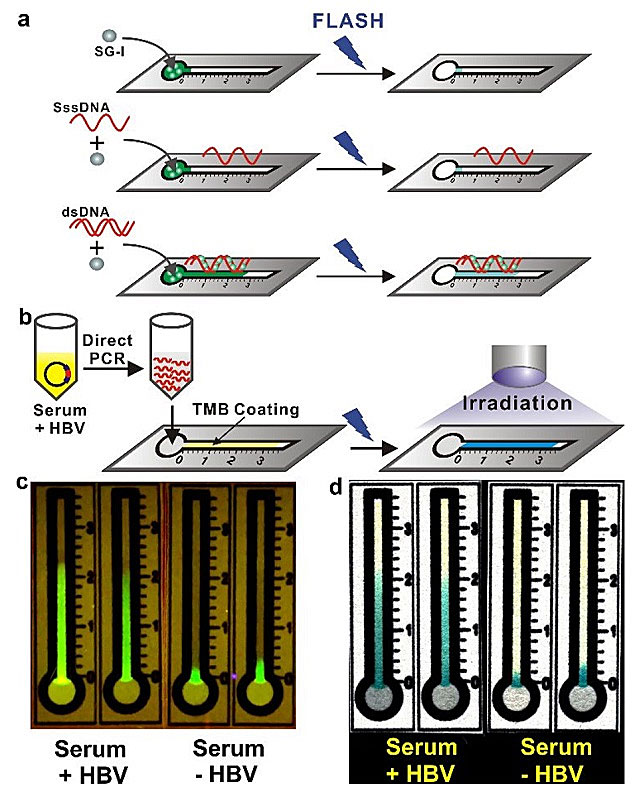
图5. 纸基FLISH测试条基于距离的核酸定量。a. FLISH测试条上的距离显影原理。b. 分析未经稀释的人血清样本中HBV基因片段的工作流程。c. 紫外灯下测量6.0×102拷贝数的HBV基因片段和空白样的距离。d. 将基于荧光的距离读出转换为通过光照和FLISH反应的比色读出。
综上所述,李峰课题组与吴鹏课题组成功开发出一种新型比色FLASH PCR平台,有助于将PCR的灵活性拓展至POCT以及现场诊断领域。仅需要将PCR扩增子与SG-I和TMB两种化合物直接混合,再进行光照即可完成FLASH反应。通过组装便携式电子信号读出装置(FLASH reader)以及纸基FLASH测试条,并采用不同的PCR方法,成功证实了FLASH-PCR的简易性和灵活性。因此他们认为,FLASH技术将很容易被用于在分散环境下进行快速、稳健且灵敏的核酸检测,从而为即时诊断以及资源有限地区疾病诊断产生真正实用的帮助。尽管目前仅利用FLASH进行PCR的终点检测,但他们相信未来实现实时FLASH PCR是完全有可能的。为了实现这一目标,他们正分别在分子和设备两方面进行努力,包括筛选更适用于实时PCR的FLISH反应物和条件,以及为FLASH装置配备加热模块等。
该研究成果于近期发表于Analytical Chemistry 杂志。四川大学李峰教授与吴鹏教授为该论文共同通讯作者,李峰课题组董天彧为本文第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Colorimetric Polymerase Chain Reaction Enabled by a Fast Light-Activated Substrate Chromogenic Detection Platform
Tianyu Dong, Hayam Mansour, Hao Hu, Guan A. Wang, Colton J. F. Watson, Michael Yousef, Gabriela Matamoros, Ana L. Sanchez, Adam J. MacNeil, Peng Wu*, Feng Li*
Anal. Chem., 2020, 92, 6456–6461, DOI: 10.1021/acs.analchem.9b05591
【参考文献】
1. Zhang, X.; Huang, C.; Xu, S.; Chen, J.; Zeng, Y.; Wu, P.; Hou, X., Photocatalytic oxidation of TMB with the double stranded DNA–SYBR Green I complex for label-free and universal colorimetric bioassay. Chem. Commun., 2015, 51, 14465-14468.
2. Wang, G.; Dong, T.; Mansour, H.; Matamoros, G.; Sanchez, A. L.; Li F., Paper-Based DNA Reader for Visualized Quantification of Soil-Transmitted Helminth Infections. ACS Sens., 2018, 3, 205-210.
导师介绍
李峰
https://www.x-mol.com/groups/li_feng_scu
吴鹏
https://www.x-mol.com/groups/wupeng_scu
本文作者:高露(gaolulucky@163.com)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号