清华大学尹航教授课题组2020年迄今工作亮点
2020年5月14日中美华人化学及化学生物学教授协会公布:清华大学药学院尹航教授获得该协会2020年度“OKeanos-CAPA资深研究员奖”。OKeanos-CAPA资深研究员奖自2015年开始设立,每年授予一名在生物与化学交叉领域成果突出的资深研究人员。OKeanos-CAPA资深研究员奖历年的获奖人包括:芝加哥大学何川教授(2015)、康乃尔大学林和宁教授(2016)、俄亥俄州立大学索祖才教授(2017)、芝加哥大学林文斌教授(2018)、北京大学陈兴教授(2019)。
尹航教授于1999年获得北京大学应用化学学士学位;2004年获得美国耶鲁大学化学专业博士学位;2004至2007年在美国宾夕法尼亚大学医学院从事博士后研究;加入清华大学之前于美国科罗拉多大学化学和生物化学系任终身教授。2018年起任清华大学药学院教授、副院长,药学技术中心主任,清华大学校学术委员会委员。尹航教授团队在本领域一流期刊发表研究论文超过120篇;科研成果已申请专利11项(授予美国、欧盟、日本等专利4项),并有多项成果已经商业化。尹航教授先后获得中组部国家特聘专家称号、国家自然基金委杰出青年科学基金、北京市卓越青年科学家项目、美国化学学会大卫•罗伯特森杰出药物化学家奖、中美化学及化学生物学教授联合会杰出青年教授奖、美国国家科学基金会杰出青年教授奖、美国癌症研究学会格特魯德•埃利恩奖、美国癌症研究学会的SU2C创新研究奖、悉德尼•金梅尔学者奖、霍华德•休斯医学研究院合作创新奖、以及美国国家卫生研究院的 NIDA 青年化学家奖等多个奖项。尹航教授现任国际细胞外囊泡协会执行理事、Journal of Extracellular Vesicle(2018影响因子11.0)责任主编。本小组的成果在新华社、美国广播公司(ABC)、Nature、Science、PNAS、美国化学会会刊C&EN 等杂志作为“科研亮点”重点报道。培养的研究生和博士后已有多名在国内外的著名大学和科研机构独立领导研究组。
尹航课题组的研究方向化学生物学、外泌体、创新药物研发等,尤其专注于天然免疫的调控和生物体不同层次间的信息传递。2020年5月19日,化学领域顶级综述期刊Accounts of Chemical Research 刊登了题为“Small-Molecule Modulators of Toll-like Receptors”的封面文章(图1),对包括尹航教授课题组近期工作在内的Toll样受体(TLR)调节剂领域研究做出了阶段性的成果总结与展望(Acc. Chem. Res., 2020, 53, 1046–1055)。近十余年来,尹航教授课题组综合利用计算机虚拟筛选、基于结构的理性设计和实体化合物库筛选等方法,已开发出多种TLR调节剂,并有多项科研成果成功转化。

图1. Account of Chemical Research 2020年五月号封二
TLR是人类免疫系统的守卫者,可以保护宿主免受细菌、病毒和其他病原微生物的侵害。TLR信号通路在各种疾病的诱发和进展中起到了关键的作用,其信号传导异常会导致许多病理状况发生,例如慢性炎症、败血症、癌症、哮喘、神经性疼痛、药物成瘾和自身免疫性疾病等。因此,对TLR信号的有效调控有利于上述疾病的治疗。目前,TLR激动剂已显示出作为抗菌剂和疫苗佐剂的巨大潜力,其中MPLA(TLR4激动剂)和咪喹莫特(TLR7激动剂)已经获得美国食品药品管理局(FDA)的批准。同样由于其重要的潜在治疗应用价值,多个TLR拮抗剂小分子也已进入临床试验的各个阶段。
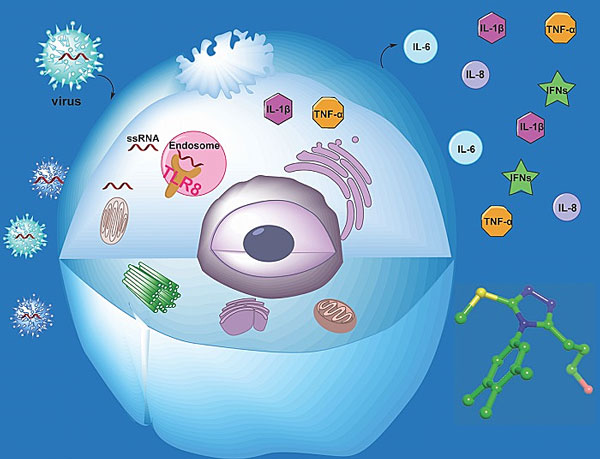
图2. Toll样受体的化学干预。图片设计:蒋双双
2020年3月31日,尹航教授带领的研究团队在药物化学领域重要刊物Journal of Medicinal Chemistry发表了题为“Rationally Designed Small-Molecule Inhibitors Targeting an Unconventional Pocket on the TLR8 Protein-Protein Interface”的文章(J. Med. Chem., 2020, 63, 4117-4132),报道了基于TLR8-TLR8蛋白作用界面而设计的新一代高活性TLR8小分子抑制剂,并在类风湿性关节炎病人的血液样本中验证了其对自身免疫病的治疗潜力(图2)。此外,在今年1月,尹航教授与挪威科技大学的Trude Flo教授课题组合作,发现TLR8在HIV病理过程中的重要作用(Nat. Commun., 2020, 11, 147),体现了这些外源小分子探针工具在研究天然免疫生物学功能中的作用。
除TLR调控剂开发外,尹航课题组近年来也尝试探索研究其它的天然免疫潜在药物靶标。例如:环状鸟苷酸-腺苷酸合成酶(cGAS)是一种胞质DNA感受器,通过STING-TBK1-IRF3信号通路产生I型干扰素等免疫应答。cGAS的异常激活与多种自身免疫性疾病有关。2020年2月,尹航团队与美国得克萨斯西南医学中心教授、cGAS的发现者陈志坚课题组合作,报道了人源cGAS蛋白的新型特异性小分子抑制剂,为设计探针研究cGAS功能和发展相关自身免疫疗法提供了新的化学骨架(J. Org. Chem., 2020, 85, 1579-1600)。
除了经典的天然免疫通路,尹航课题组近期也探索了非经典炎症反应的调控。败血症源于细菌侵染血液释放的脂多糖(LPS)引发的免疫因子风暴,以往针对传统的LPS靶点TLR4的抗败血症药物均在临床失败,表明单纯的TLR4抑制可能不足以逆转败血症的发展。基于这个崭新策略,尹航课题组2020年5月18日在Advanced Biosystems 发表论文,提出了一种使用单个小分子同时抑制TLR4与非经典的LPS受体caspase的策略(Adv. Biosys., 2020, DOI: 10.1002/adbi.202000037)。小鼠实验表明该策略相较于传统的TLR4单靶点抑制剂TAK242在缓解LPS引发的小鼠脏器损伤、提高小鼠的存活率等方面表现出更好的效果,证明了双靶点抑制剂在小鼠败血症模型中有更高的活性。这项工作也为临床治疗败血症提供了新的策略与模式。

图3. 通过抑制葡萄糖转运蛋白(GLUTs)来减缓肿瘤增殖。图片设计:高麒欣
最后,天然免疫与细胞的能量代谢息息相关。2020年5月16日,Protein & Cell杂志报道了题为“Regulation of Aerobic Glycolysis to Decelerate Tumor Proliferation by Small Molecule Inhibitors Targeting Glucose Transporters”的研究论文(Protein Cell, 2020, DOI: 10.1007/s13238-020-00725-7)。尹航课题组与清华大学药学院、医学院研究人员通力合作,基于前期报道的GLUTs蛋白结构设计小分子抑制剂,进而通过抑制肿瘤细胞的糖代谢来减缓肿瘤的增殖(图3)。该研究利用肿瘤细胞对葡萄糖大量需求的这一代谢特征,通过设计GLUT1/3小分子抑制剂,从而抑制肿瘤细胞的“大量进食”,并进一步减缓肿瘤细胞的增殖。该工作表明肿瘤细胞对代谢底物的巨大需求为治疗肿瘤提供了新的策略和机会,同时GLUTs可能成为治疗代谢重编程的肿瘤的新靶点。

图4. 清华大学药学院尹航课题组近期合影
导师介绍
尹航
https://www.x-mol.com/university/faculty/46697
http://www.sps.tsinghua.edu.cn/cn/team/team/2017/1221/104.html
课题组网页
http://www.sps.tsinghua.edu.cn/yinlab/Index.html
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号