山东大学刘新泳与展鹏课题组在抗艾滋病药物研究领域取得系列新进展
艾滋病(AIDS)是当今人类社会面临的最严重的传染病之一,其主要病原体为人免疫缺陷病毒1型(HIV-1)。以多种不同靶标药物联合应用为特征的高效抗逆转录病毒疗法(cART)成为目前临床上艾滋病防治的主要手段。尽管如此,cART的长期应用仍然带来了诸多风险,包括HIV-1的高突变率和基因重组率导致的严重耐药性、复杂的药物与药物相互作用、毒副作用等,亟需研发新型抗病毒药物,通过拓展临床治疗方案以改善这一现状。
山东大学刘新泳教授(点击查看介绍)团队针对抗艾滋病药物研究领域的关键科学问题,通过对上市药物的结构优化发现新一代高效抗耐药性候选药物;同时针对新靶标,发现新骨架新机制抗病毒先导化合物。最新进展如下:
一、以 HIV逆转录酶为靶标的抗艾滋病候选药物的发现
以HIV-1逆转录酶为靶标的非核苷类抑制剂(NNRTIs)具有高效、低毒等优点,是cART疗法的重要组成部分。尽管如此,现有靶向逆转录酶的药物依然产生了耐药性,甚至包括第二代的NNRTIs依曲韦林(ETR)及利匹韦林(RPV)。此外,这两个药物在临床上均出现了不同程度的毒副作用。近年来国内外有多种结构类型的NNRTIs被相继报道,耐药性问题与毒副作用依旧没有得以克服。因此,新一代非核苷类抗艾滋病药物的研发刻不容缓。HIV-1 逆转录酶柔性强、存在诱导契合效应,给抗耐药性药物的合理设计带来很大挑战。
鉴于此,刘新泳教授团队根据逆转录酶结构,运用靶向保守性区域与蛋白溶剂界面新位点(毗邻位点、P236 开口区、进入通道)、形成主链氢键等抗耐药性药物设计新理念,进行多位点药效团模型指导下的优势药物骨架结构的优化,经抗病毒活性筛选及成药性评价,发现了一批具有显著抗耐药性及成药性的先导化合物及候选药物(J. Med. Chem., 2016, 59, 7991; J. Med. Chem., 2017, 60, 4424)。代表性化合物为噻吩并嘧啶类化合物K-5a2和25a,对HIV-1野生株和多种突变株的活性优于ETR。特别是化合物25a是目前已知活性及抗耐药性最佳的HIV-1 NNRTI,但细胞毒性(CC50 = 2.30 μM)和心脏毒性(hERG,IC50 = 0.18 μM)依然较大。
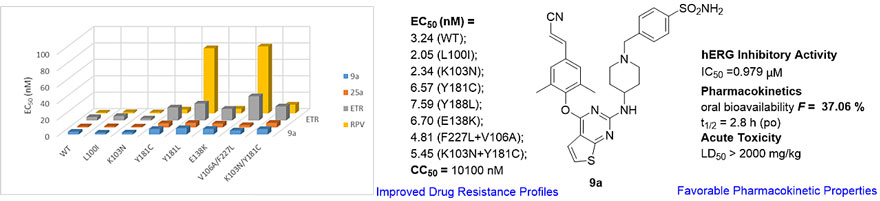
在此情况下,该团队近期运用结构生物学(Elife. 2018, 7. pii: e36340;J Med Chem. 2020, 63, 1298)指导的结构优化,得到了抗病毒活性与25a相当的化合物9a,对HIV-1野生株和多种临床常见耐药株的活性均为纳摩尔水平(EC50 = 2.05-7.59 nM)。值得注意的是,9a的细胞毒性(CC50 = 10.1 μM)和心脏毒性(hERG,IC50 = 0.9 μM)较25a均显著降低。
进而检测了K-5a2、25a、9a和上市的核苷类逆转录酶抑制剂(NRTIs)的表型交叉耐药性。将感染HIV-1的MT4细胞在不同浓度的K-5a2、25a和9a中传代培养30次,基因测序发现HIV-1 RT依旧会发生多个残基突变位点。进一步的活性测试发现三者对这些多突变株的活性明显下降,与K-5a2和25a相比,9a对这些突变株具有相对最优的抗耐药性(9ares strain, EC50 = 3.60 μM; K-5a2res strain, EC50 = 1.78 μM; 25ares strain, EC50 = 0.87 μM)。但是齐多夫定对这些突变株(9ares strain, EC50 = 1.0 nM; K-5a2res strain, EC50 = 5.1 nM; 25ares strain, EC50 = 4.9 nM)表现出了优于对野生株(EC50 = 12.7 nM)的活性,尤其是对于9ares strain,其活性比野生株提高了近12倍。该结果充分说明9a不会导致不同机制抑制剂的交叉抗耐药性;9a具有良好的大鼠口服生物利用度(F = 37.06%)与安全性(LD50 > 2000 mg/kg),是值得继续开发的优质候选药物,有望作为cART疗法的组分与NRTIs联用来于艾滋病的治疗。
上述研究内容已发表在药物化学领域国际权威期刊Journal of Medicinal Chemistry上 [1],第一作者为山东大学特别资助类博士后康东伟,山东大学药学院的刘新泳教授、展鹏副教授及比利时鲁汶大学Christophe Pannecouque教授为本论文的共同通讯作者。
二、基于靶标结构发现新型HIV-1衣壳蛋白抑制剂
发现新靶标新机制抑制剂可从根本上克服现有临床抗病毒药物的耐药性问题,通过“另起炉灶”,可达到“釜底抽薪”之效。衣壳蛋白(Capsid protein,CA)在HIV-1复制周期的早期和晚期中多个环节均发挥着重要作用,同时成熟的CA还可以保护内部的病毒基因免受外界破坏,因此CA成为抗HIV-1药物研究的新靶点。
近日,刘新泳教授团队以HIV-1衣壳蛋白六聚体相邻亚基蛋白界面为靶标,构建基于苯丙氨酸优势片段的化合物库,经体外细胞水平的抗病毒活性筛选(HIV-1NL4-3/TZM-bl细胞;HIV-1IIIB、HIV-2ROD/MT-4细胞)及机制研究发现了一系列新颖的苯丙氨酸类衣壳蛋白抑制剂。其中,化合物11l抗HIV-1活性最佳(EC50NL4-3= 90 nM;EC50IIIB= 0.21 μM),是先导化合物PF74的4-6倍(EC50NL4-3= 520 nM;EC50IIIB= 0.87 μM)。此外,化合物11l表现出了显著的抗HIV-2ROD活性(EC50 = 31 nM),是先导化合物PF74的120倍(EC50 = 3.69 μM),安全性也大幅提高(SI:5768 vs 39)。SPR实验表明,11l与CA六聚体具有较高的亲和力,初步确证了化合物的作用位点。进一步的机制实验表明,在病毒复制晚期,11l通过干扰HIV-1 CA组装产生传染性较小的病毒颗粒来发挥作用;而在复制早期(值得注意的是,11l早期抑制活性为PF74的6倍:9 nM vs 56 nM),11l通过选择性结合到HIV-1 CA起作用,加速病毒脱壳,使其与逆转录过程不相容。分子动力学模拟为11l的高效抗病毒活性提供了合理解释。此外,11l的人血浆和肝微粒体稳定性略优于PF74,且具有良好的大鼠药代参数和口服生物利用度(F=23%)。安全性实验显示单剂量1000 mg•kg-1的11l对健康昆明小鼠无急性毒性。
以上结果显示了以HIV-1 CA为靶点的抗艾滋病药物研发的前景。而随着全球化的不断深入以及各国人员往来日益密切,HIV-1/HIV-2的传播范围也势必日渐扩大,由于11l具有高效的HIV-1/HIV-2双重抑制作用,因此以11l为先导化合物作进一步的研发具有重要的价值。

上述研究成果已发表在Journal of Medicinal Chemistry上 [2],第一作者为山东大学药学院在读博士生孙林,刘新泳教授、展鹏副教授、北卡罗来纳大学Kuo-Hsiung Lee教授及德雷克塞尔大学Simon Cocklin教授为本论文的共同通讯作者。目前,该成果已申请多项中国发明专利(申请号:201910207026.6; 201910207029.X; 201910206946.6)。
在抗艾滋病药物先导化合物发现及优化中,针对靶标极易突变、柔性强、配体结合的诱导契合效应等药物设计难点,发展一系列基于靶标的药物设计方法(部分内容见近期出版专著《基于靶标的抗艾滋病药物研究》),例如,靶向新结合位点、保守区域、形成主链氢键、多价态、多位点及多靶点的抗耐药性药物设计策略;靶向蛋白溶剂界面的多系数结构优化策略;这些抗病毒药物研究共性方法与技术有望为研发应对重大疫情的新药提供参考。
抗病毒药物研究工作得到多项科技部、国家自然科学基金委国际合作重点项目及面上项目的持续资助以及山东省重大创新工程项目等项目的资助。
1. 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Structure-Based Bioisosterism Yields HIV 1 NNRTIs with Improved Drug Resistance Profiles and Favorable Pharmacokinetic Properties.
Dongwei Kang, Da Feng, Yanying Sun, Zengjun Fang, Fenju Wei, Erik De Clercq, Christophe Pannecouque, Xinyong Liu, Peng Zhan
J. Med. Chem., 2020, DOI: 10.1021/acs.jmedchem.0c00117
2. 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Design, Synthesis, and Mechanism Study of Benzenesulfonamide-containing Phenylalanine Derivatives as Novel HIV-1 Capsid Inhibitors with Improved Antiviral Activities.
Lin Sun, alexej dick, Megan E. Meuser, Tianguang Huang, Waleed A. A Zalloum, Chin-Ho Chen, Srinivasulu Cherukupalli, Shujing Xu, Xiao Ding, Ping Gao, Dongwei Kang, Erik De Clercq, Christophe Pannecouque, Simon Cocklin, Kuo-Hsiung Lee, Xinyong Liu, Peng Zhan
J. Med. Chem., 2020, DOI: 10.1021/acs.jmedchem.0c00015
导师介绍
刘新泳
https://www.x-mol.com/university/faculty/22653
展鹏
https://www.x-mol.com/university/faculty/23546
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号