苏州大学:表面辅助光致穿孔实现外源大分子向细胞内的高效传输
治疗性外源大分子(如多糖、蛋白质、RNA、DNA和药物分子等)的高效细胞传输是生物科学和生物医学工程研究中的一种重要手段,能够有效用于细胞工程以及癌症等多种疾病的治疗。关于外源大分子的细胞传输方法的研究也一直受到各国科研工作者的密切关注。目前常用的传输方法往往难以同时满足高传输效率和低细胞毒性这两个基本条件。因此,如何在保证传输安全性、减小细胞毒性的前提下提高外源大分子的细胞传输效率是目前该领域的一个研究热点和难点。
苏州大学材料与化学化工学部大分子与生物表界面实验室(MacBio)在多年以来生物材料表界面的研究积累之上,开发了一种基于表面辅助光致穿孔实现外源大分子向细胞内高效传输的方法。该方法巧妙利用了纳米材料表面在近红外激光照射下产生的光热效应,在没有外加载体,不损失细胞活性的前提下,实现了多种不同种类外源大分子(包括多糖分子、质粒DNA)向多种细胞的高效传输。对于常规细胞系(如HeLa细胞),该方法可以实现对多糖分子与质粒DNA近100%的传输效率,且很好地保持了细胞活性。对于难转染的细胞系,例如小鼠胚胎成纤维细胞(mEFs),该方法在没有载体的情况下的转染效率远远优于商品化转染试剂Lipofectamine 2000(53% 对19%)。而对于应用Lipofectamine2000更难转染的人脐带静脉内皮细胞(HUVECs),在Lipofectamine2000复合的基础上结合该方法,可以将转染效率从8%大幅提升到44%。更重要的是,由于本体系中材料表面上的纳米粒子彼此紧密结合,该方法能够有效避免由于单个纳米粒子进入细胞而导致的潜在细胞毒性问题。该方法不同于传统的大分子传输方法(如载体法、电转法等),通过优化条件,能够同时实现高细胞活性与高转染效率,为外源性大分子的细胞传输提供了一种高效可靠的新方法。
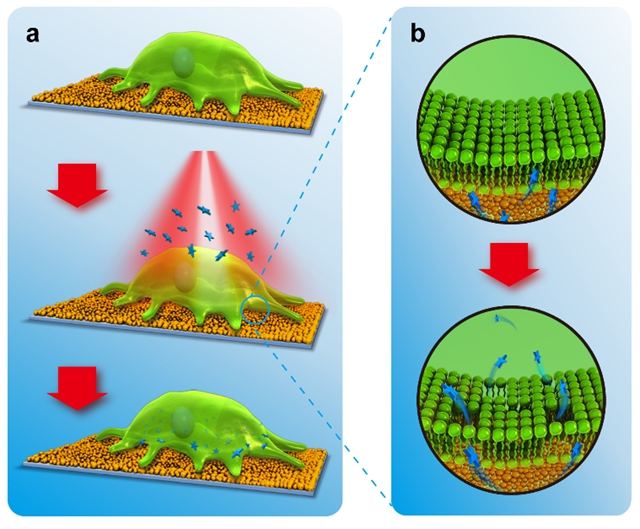
图1 表面辅助光致穿孔实现外源大分子向细胞内的高效传输的示意图
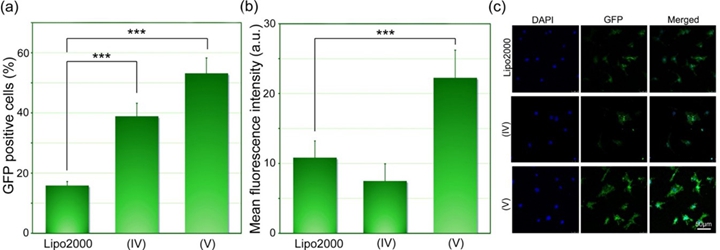
图2 表面辅助光致穿孔方法实现GFP向mEFs细胞内转染与Lipofectamine 2000复合转染效率对照
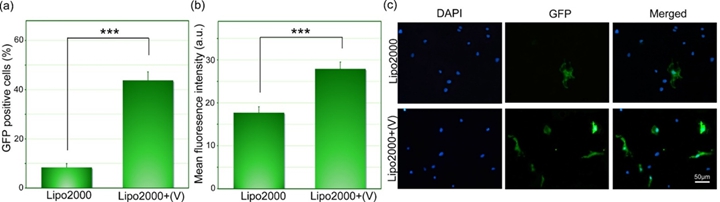
图3 Lipofectamine 2000复合结合表面辅助光致穿孔方法后实现GFP向HUVECs细胞内转染与单纯Lipofectamine 2000复合转染效率对照
该研究成果近期作为内封面(Inside Front Cover)文章在《先进功能材料》(Advanced Functional Materials)杂志上报道,共同第一作者是博士生吕仲林和周峰博士,共同通讯作者是于谦副教授和陈红教授,同时已申报国家发明专利。目前该技术已由相关生物科技有限公司转化,成功研制出了第一代全自动表面辅助光致穿孔大分子传输仪,不久的将来即可将该仪器推向需求市场。

该研究工作得到了国家自然科学基金、江苏省自然科学基金和江苏高校优势学科建设工程资助项目的大力支持。
http://onlinelibrary.wiley.com/wol1/doi/10.1002/adfm.201602036/full
原文:A Universal Platform for Macromolecular Delivery into Cells Using Gold Nanoparticle Layers via the Photoporation Effect
Adv. Funct. Mater., 2016, 26, 5787-5795, DOI: 10.1002/adfm.201602036
