从大连化物所的Nature Chem.说开去——合成氨,老反应新故事
氨气,作为化学里面最耳熟能详的气体之一,也是最基本的化工原料之一。大自然有固氮菌来还原空气中的氮气,而氨气的人工制备,最早要追溯到1898年。德国A.弗兰克等人发现氮气能与碳化钙(CaC2)反应生成氰氨化钙(又称石灰氮)。之后如果进一步与水蒸气反应,即可获得氨:CaCN2+3H2O → 2NH3+CaCO3。随后,这种方法被工业化,称为“氰化法”。但是这种制备路线需要电石为原料,能耗太高,而且无法大规模生产,只能生产少量的氨气,用于军事用途。考虑到氨气在化工领域的强烈需求,开发更加廉价可行的合成氨方法成了当时化工领域的非常瞩目的研究方向。
在20世纪初,欧洲是世界科学的中心。欧洲的化学家们也对合成氨很感兴趣。有兴趣的读者可以参考这篇博客1,里面介绍了一些关于一百多年前欧洲科学家们研究合成氨反应的“八卦”故事。简单来说,经过非常艰苦的理论和实验上的研究,德国人掌握了以氢气和氮气为原料,负载型的Fe为催化剂,在100-200个大气压、500-600 ℃条件下得到氨气。人类的人口在20世纪迎来爆炸,合成氨反应可以说居功至伟,因为要养活这么多人,离不开大量的氨。因此合成氨反应也被称为多相催化中的“bellwether”反应[M. Boudart, Top. Catal., 1, 405-414 (1994)]。德国化学家Fritz Haber因为在开发合成氨工艺中的杰出贡献而获得1918年的诺贝尔化学奖。Fritz Haber是一位饱受争议的科学家,曾经研究过化学武器,并在一战中造成大量的伤亡[Dunikowska, M. & Turko, L. Angew. Chem. Int. Ed., 50, 10050-10062 (2011)]。但是,从科学贡献上,Haber还是一位杰出的科学家。现在德国马普学会有一个研究所是以Haber来命名的(Fritz-Haber-Institut der Max-Planck-Gesellschaft),以物理化学的研究见长。2007年诺贝尔奖得主Gerhard Ertl就是在这个研究所工作。Ertl的一部分代表性的工作就是在以合成氨反应为模型催化剂来研究表面科学问题。

图1. 位于波兰Lower Silesian省的Wrocław Salon Slaski俱乐部里面挂着两排这个省诞生的诺贝尔奖得主。其中两幅肖像是倒立的。一幅是Haber的,另一幅是阴极射线的发明者Philipp Lenard。Lenard后来成为种族主义者。
由于N2中的N≡N非常稳定,因此N2+H2反应在动力学上非常非常困难。因此,虽然经过了几代人不断的优化,合成氨反应仍然需要苛刻条件。有数据统计,全世界花在合成氨上的能源占全人类能源消耗的1-2%。虽然合成氨反应已经工业化100多年,但如果能够让合成氨在温和的条件下进行,还是有非常重要的意义的[Schlogl, R. Angew. Chem. Int. Ed., 42, 2004-2008 (2003)]。最近几年,也有不少研究人员发挥想象力,从不同的角度来对这个古老的催化体系进行研究,期望发展新的催化体系(如电催化,光催化等)来降低合成氨的能耗[Licht, S. et al. Science, 345, 637-640 (2014);Zhu, D. et al. Nature Mater., 12, 836-841, (2013)]。这些新的催化体系很有趣,但考虑到氨的需求量是如此的巨大,在目前的化工体系下,最可行的还是在多相催化的框架下进行改良。
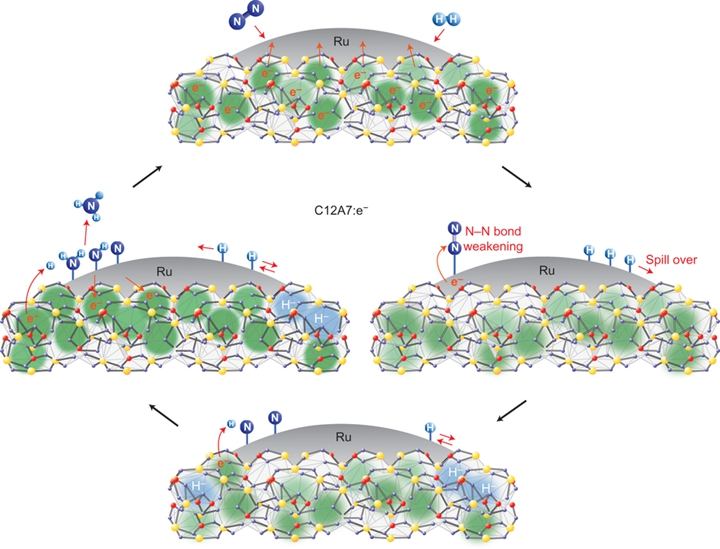
图2. 电子化合物作为给电子的载体,使Ru纳米粒子表面电子富集,从而促进氮气活化,进而加氢得到氨气。图片来源:NPG
从动力学角度来说,N2的活化是合成氨反应中非常重要的一步。考虑到N2的活化一般是需要金属的电子转移到N2的分子轨道上来活化N≡N键。于是,一个思路就是,让金属表面的电子富集,从而促进电子的转移。2012年,日本Hideo Hosono教授(也是铁基超导材料的开创者)报道了应用电子化合物[Ca24Al28O64]4+(e-)4做载体,提高Ru的表面电子密度,从而提高低压下的合成氨反应性能,如图2所示[Kitano, M. et al. Nature Chem., 4, 934-940 (2012)]。相比于传统的负载型Ru催化剂,电子化合物负载的Ru能够在常压下得到更高的TOF和低的活化能。沿着这个思路,Hosono教授和他的合作者又开发了一系列的催化剂。在他们最近的一项工作中,理论和实验结果表明,在Ru/电子化合物催化剂中,N≡N键的活化不是决速步骤。关键的步骤变为-NHx的形成[Kitano, M. et al. Nature Commun., 6, 6731 (2015)]。虽然说他们合成的电子化合物[Ca24Al28O64]4+(e-)4可以稳定存在,但是制备起来却不容易。因此,大规模的工业应用还是有困难。
从热力学角度来说,合成氨反应是放热反应,因此根据勒夏特列原理,原则上低温应该是有利于反应的进行的。然而,在合成氨反应中的中间体(NHx,x=0,1,2)会吸附在金属表面,他们需要在高温下脱附,否则催化剂就“中毒”了。这就是所谓的,反应能垒与反应物种NHx(x=0,1,2)的吸附能之间存在着限制关系(Scaling relations)[Vojvodic, A. et al. Chem. Phys. Lett., 598, 108-112 (2014)]。换言之,如果能找到一种催化材料,使得N能够被加氢,并且吸附能不是很高,那么就可以实现低温下的合成氨反应了。然后,研究人员经过大量的尝试,发现似乎基于金属催化体系(单金属或者合金)的催化剂都很难克服上述限制关系。合成氨反应工业化100多年了,而现在使用的催化剂和当初最早开发的居然非常类似。这在多相催化工业史上是不多见的。
最近,中国科学院大连化学物理研究所(大连化物所)陈萍(Ping Chen)研究员和郭建平(Jianping Guo)博士研究团队在这个“经典菜品”中加入了“新调料”。研究团队将氢化锂(LiH)作为第二组分引入到负载型的过渡金属催化剂中,构筑了“过渡金属—氢化锂(TM-LiH)”这一双活性中心催化剂体系,显著提高了传统金属催化剂在温和条件下的合成氨性能。论文发表在Nature Chemistry,第一作者为博士研究生王培坤(Peikun Wang)和常菲(Fei Chang)。(Breaking scaling relations to achieve low-temperature ammonia synthesis through LiH-mediated nitrogen transfer and hydrogenation. Nature Chem., 2016, DOI: 10.1038/nchem.2595)

图3. a) 在过渡金属-氢化物双组份催化剂上,N2分子的活化和加氢过程的示意图。b,c) 一系列双组份催化剂的活性结果。
如图3a所示,N2分子在过渡金属(TM)表面解离生成TM-N;之后N原子从金属表面向LiH迁移而生成Li-N-H物种;N物种在LiH上进一步被加氢成NH3,并且顺利从LiH表面脱附。双活性中心的构筑使N2和H2的活化及中间产物的吸附发生在不同的活性中心上,从而打破了反应能垒与吸附能之间的限制关系。他们的实验结果表明,由于LiH的加入,过渡金属及其氮化物(从VN到Ni)均显示出较高的活性。如图3b和3c所示,这些样品在350°C和10个大气压条件下,其催化活性显著优于现有的Fe基和贵金属Ru基催化剂。特别的是,Fe-LiH和Co-LiH复合催化剂在150°C即表现出可观量的活性,证明了双中心作用机制下氨的低温合成是一条可行的路。

陈萍研究员。图片来源:大连化物所
陈萍研究团队的成果是几年来合成氨反应方向的重要突破,为发展更加节能的催化剂开创了新的思路。对于过渡金属-氢化物这样的催化体系,人们的认知还不是很充分。相信在不远的未来,借助各种先进的表征手段(如XPS,XAS等),对于这样的双中心催化体系会有更加深刻的理解,推动这个催化体系的进一步发展。
1. http://blog.sina.com.cn/s/blog_6f373a330102ve0j.html
2. https://www.nature.com/articles/nchem.2595
(本文由拉蒙供稿)
