ACS Catal.:炔酰胺介导的大环内酯化反应
大环内酯是环上含有8个原子以上的环内酯类化合物的统称,这类结构广泛存在于具有重要生物活性的天然产物、抗生素、抗癌药物之中,如红霉素、阿奇霉素等都属于大环内酯类药物(图1)。但是,大环内酯的构建不管是理论上,还是在实际操作中都极具挑战性。因此,大环内酯类化合物的合成一直是有机合成化学家广泛关注的一个课题。经过几代化学家的不懈努力,发展了一批大环内酯的成环方法,包括过渡金属催化的C-O键形成、炔烃/烯烃关环复分解反应、烯烃偶联反应构建C-C键、氮杂环卡宾(NHC)催化醛类的氧化酯化等反应。但是这些方法经常涉及到苛刻的反应条件,而且其关环前体难以获得。同时,它们大多需要使用过渡金属催化剂,这在复杂大环内酯类天然产物及大环内酯类药物合成中是极为不利的,这些因素导致它们难以获得广泛应用。
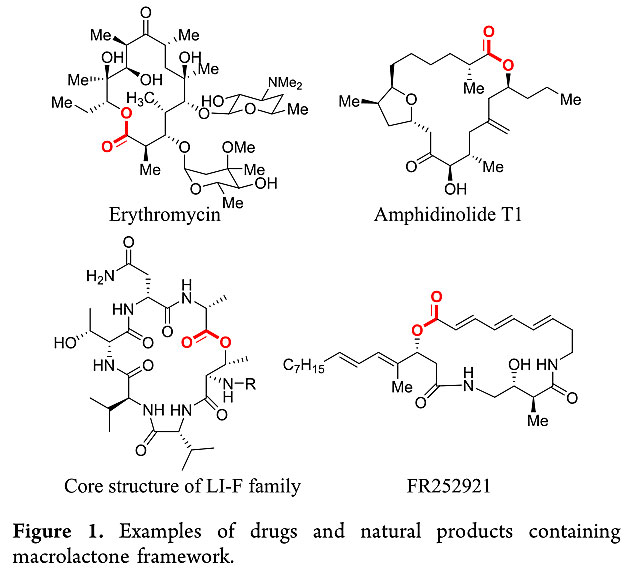
图1. 含有大环内酯骨架的代表性天然产物及药物。图片来源:ACS Catal.
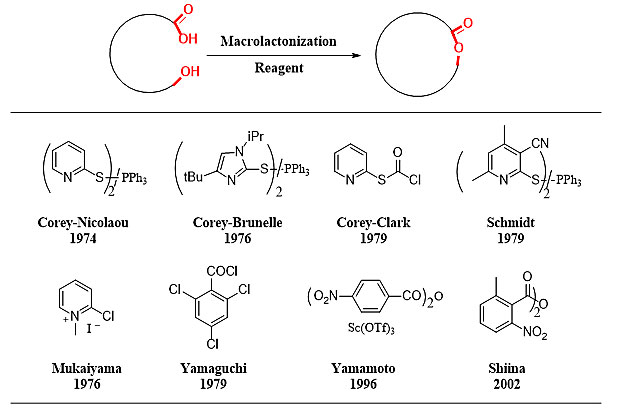
图2. 代表性大环内酯化人名试剂
目前大环内酯关环最为普遍的策略是通过羟基酸的分子内酯化来实现的。虽然这一过程的熵效应和焓效应对反应都是不利的,但是由于该策略的关环前体原料易得,所以一直受到有机合成化学家的青睐。目前,能够促成羟基酸关环的试剂主要是由几种人们广为熟知的人名试剂或人名反应来实现的(图2)。这些大环内酯化反应也都有其各自的不足,它们所面临的一个共同的问题是羟基酸会先发生分子间反应,生成二聚羟基酸之后再发生分子内酯化反应生成副产物。这些试剂的使用一般要用过量的4-N,N-二甲氨基吡啶、三乙胺等碱作为添加剂,或者有些试剂本身就具有碱性,这种碱性环境不但会导致含有α-手性中心的羟基酸底物α位发生外消旋化,而且会造成含有α,β-不饱和羟基酸底物中与羧基共轭的烯烃碳碳双键的Z/E异构化。目前二聚副产物的问题主要是通过降低关环前体的浓度来实现的,因此大环内酯化反应一般是在小于1 mM浓度下来进行的。然而α-手性羟基酸的外消旋化与α,β-不饱和羧酸的Z/E异构化这两个问题还未能得到很好的解决,尤其是含有共轭多烯单元的大环内酯类天然产物,他们的合成仍然是非常棘手的问题。同时这些方法一般要求在无水、高温条件下进行,增加了实际操作的难度。
江西师范大学赵军锋教授(点击查看介绍)课题组一直致力于多肽和蛋白质的化学合成与修饰的研究工作,他们发展了一种原创的炔酰胺类缩合试剂。该类缩合试剂适用于普通酰胺键和多肽的合成(J. Am. Chem. Soc., 2016, 138, 13135-13138)。其特点是反应活性比较温和,能够很好的抑制α-氨基酸在活化及酰胺键形成过程中的外消旋化。在此基础上,他们通过巧妙的设计,利用炔酰胺类缩合试剂与单硫代氨基酸的选择性反应,实现了更具挑战性的硫代多肽的合成(Angew. Chem. Int. Ed., 2019, 58, 1382-1386)。炔酰胺类缩合试剂在酰胺键与硫代酰胺键的构建上体现出了前所未有的优越性,为了将这类缩合剂早日发展成为具有工业应用价值的缩合剂,该课题组还开发出了从廉价易得的化工原料出发,一步合成炔酰胺的方法(Org. Lett., 2018, 20, 208-283; J. Org. Chem., 2019, 84, 4458-4466.),大大降低了炔酰胺的合成成本。同时,为了进一步拓展炔酰胺类缩合剂的应用范围,该课题组发展了炔酰胺介导的大环内酯化反应,合成了一系列大环内酯类化合物,并将其成功地用于大环内酯肽类天然产物全合成中,相关成果发表在ACS Catalysis 上。
在多肽与硫代多肽合成中,作者发现炔酰胺类缩合剂在促成肽键形成时,丝氨酸、苏氨酸、络氨酸的侧链羟基都不需要保护,这说明在酰胺键形成的条件下,羟基的酯化反应不会发生,这主要是由于羟基氧的亲核性比氨基亲核性弱造成的。但是在他们后期进行炔酰胺介导的肽键形成反应条件优化时发现,当使用弱酸性的三氟乙醇作为肽键形成反应的溶剂时,他们检测到有少量酯化副产物产生。与此同时,理论计算也表明酸催化剂可以加速炔酰胺介导的酰胺键形成(Org. Biomol. Chem., 2017, 15, 6367-6374.)。这可能是由于酸催化剂通过质子化烯醇酯烯烃末端碳降低了酯交换反应的能垒,因此作者提出在酸催化剂的作用下,炔酰胺类缩合剂将有望用来促成酯化反应(图3)。
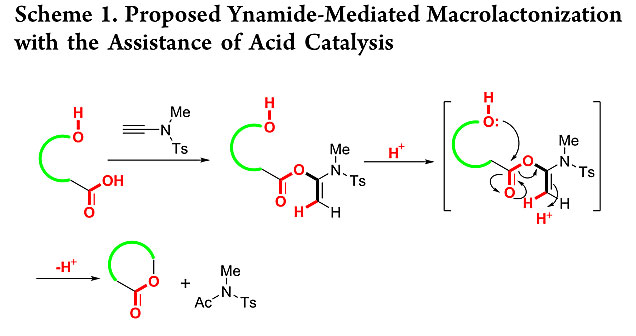
图3. 炔酰胺介导的大环内酯化可能的反应机理。图片来源:ACS Catal.
他们选择最具挑战性的大环内酯化反应为研究目标,前面他们已经知道羟基羧酸可以顺利的与炔酰胺缩合剂反应生成几乎定量的烯醇活化酯。为了研究源于羟基酸的烯醇活化酯与其自身的羟基进行酯化的反应效率,他们以活化酯2j作为一个模型底物。系统的反应条件优化表明溶剂、酸催化剂、反应物浓度等对反应效率都有一定的影响。作者发现在酸催化剂的作用下,以二氯甲烷作为反应溶剂,活化酯2j在室温下即可顺利进行酯化关环反应。在10 mM的浓度下进一步对酸催化剂进行筛选,他们发现布朗斯特酸比路易斯酸催化效果要好很多,且对甲苯磺酸一水合物(PTSA•H2O)为最佳催化剂(图4)。因为他们前期已经发现炔酰胺与羧酸的加成反应的最佳溶剂是二氯甲烷,因此,这两步反应可以做成“两步一锅法”,只需要在羟基酸活化这一步反应完之后,在反应体系中加入15 mol%的PTSA•H2O催化剂,室温下搅拌几个小时即可完成反应。在此条件下只观察到极其少量的二聚副产物生成,将关环前体浓度降低到5 mM的浓度下可完全抑制二聚体的产生。值得注意的是不像其他大环内酯化反应体系对水非常敏感,该反应体系可以容忍少量水的存在。因此该方法条件温和、操作简单,溶剂无需做无水处理,反应在敞口容器中即可进行。
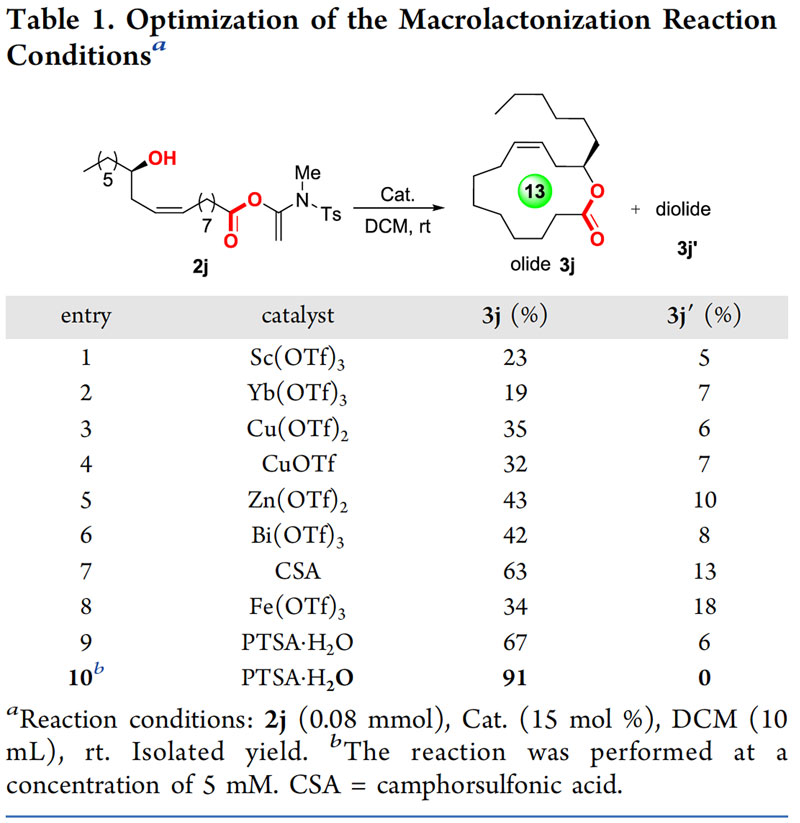
图4. 大环内酯化反应条件的优化。图片来源:ACS Catal.
在确定了标准反应条件后,接下来作者对该方法的底物范围进行了考察(图5)。作者发现各种羟基酸都可以在该条件下进行大环内酯化反应。对于含有较长脂肪链的羟基酸,由于其酸性降低,其与炔酰胺进行加成时反应速率较慢,但作者发现可以通过加入15 mol%的CuCl催化剂来加速反应。另外,他们发现除了一级醇羟基外,二级醇羟基也可以高效的进行反应。一般来讲,8-13元环中等大小的大环内酯是最难合成的,作者发现这些困难产物也能用这种方法快速构建(3b-3j)。含有α,β-不饱和键的羟基酸在该反应体系中也能够以很好的收率得到目标产物(3f和3k),没有观察到C2-C3双键的Z/E异构化。该方法还可以应用到含有酰胺键的底物中去(3o–3s),手性α-氨基酸的光学纯度得到了完好的保持。这些反应都可以通过“一锅法”的操作来实现(3p),操作简单、方便。另外值得一提的是传统大环内酯化反应必须在小于1 mM的浓度下进行,该方法则可以在5-100 mM浓度范围来操作。这个优点在大量反应时显的特别重要,因为可以节约大量的溶剂。
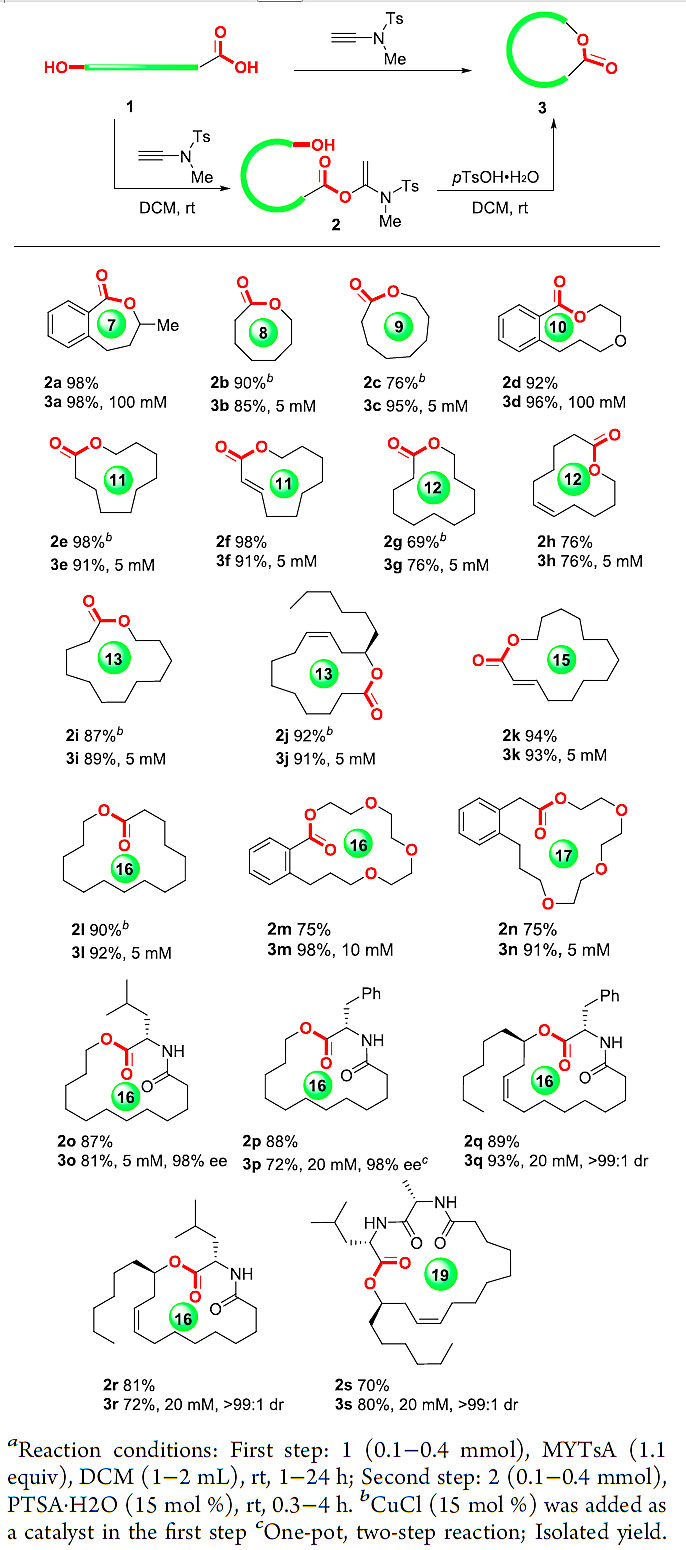
图5. 炔酰胺介导的大环内酯化实用性考察。图片来源:ACS Catal.
为了展示该方法在复杂天然产物全合成中的应用,他们利用该方法作为关键步骤,成功实现了大环内酯肽类天然产物Dehydroxy LI-F04a的化学全合成。Dehydroxy LI-F04a是一种具有重要抗生素活性的大环内酯肽类天然产物,其母体是一个由六个氨基酸构成的环酯肽结构片段。理论上来讲,环酯肽结构片段可以通过任一酰胺键或者酯键的形成来关环。但是有不少多肽片段在形成分子间酯键时非常困难,通过酯键的形成来关环成为一种大环内酯肽合成策略中具有“一石二鸟”效果的不错选择。Dehydroxy LI-F04a就是这样的一个例子,Jolliffe团队对Dehydroxy LI-F04a的全合成进行过深入系统的研究,她们发现其分子间酯键构建非常困难,因此她们提出通过酯键的形成也就是大环内酯化来关环的策略。但是,她们尝试的很多种大环内酯化方法都失败了,这些方法要么是根本没有产物生成,要么是有大量的二聚体副产物生成。更加糟糕的是这些传统方法在关环位点的(D-Ala)会产生严重的差向异构化,而这个位置的手性对其活性起着至关重要的作用,因为其手性反转会导致其抗真菌活性的完全丧失(Beilstein J. Org. Chem., 2012, 8, 1344-1351.)。她们最后利用改进的Yamaguchi大环内酯化方法以94:6的dr值和52%的收率实现了环酯肽骨架的构建(图6,Table 2,entry 9)。为了考察炔酰胺类缩合剂在该天然产物全合成中的使用效果,作者通过固相合成的方法把直链多肽片段合成出来,然后用炔酰胺缩合剂与其他传统缩合方法一起来考察其关环效率(图6)。在使用其他缩合试剂时作者观察到了与Jolliffe课题组一样的结果,大部分缩合试剂导致了二聚体和严重的外消旋化。有意思的是当炔酰胺作为缩合试剂时,作者可以92%的收率和大于99:1的dr值的绝对优势成功构建了该19元环内酯肽核心骨架,随后以五步40%的总收率实现了Dehydroxy LI-F04a的全合成(图7)。

图6. 不同大环内酯化策略的对比研究实验。图片来源:ACS Catal.
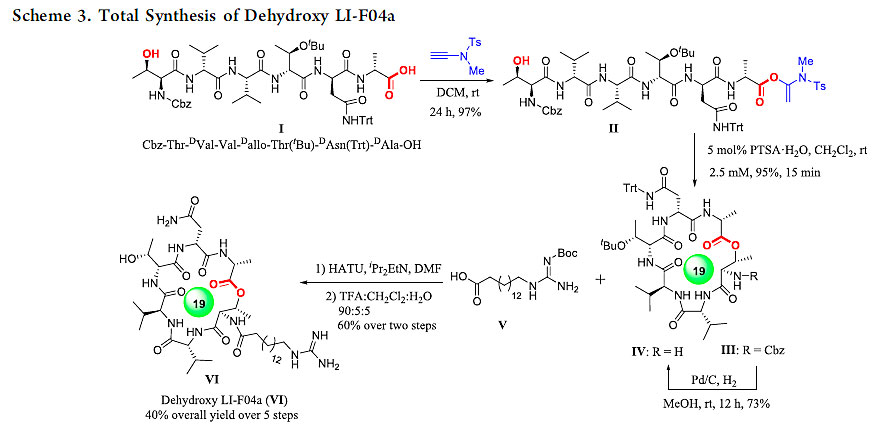
图7. 天然产物Dehydroxy LI-F04a的全合成。图片来源:ACS Catal.
总结
赵军锋教授课题组成功开发了炔酰胺介导的大环内酯化反应,该方法解决了传统大环内酯化反应中经常遭遇到的α-手性羟基酸消旋异构化的问题,以及α,β-不饱和羟基酸碳碳双键Z/E异构化的问题。该方法操作简单、反应条件温和、底物范围广、对多种官能团和少量水的耐受性强,相信该方法将会在大环内酯类化合物合成中获得广泛的应用。
相关研究工作近期发表在ACS Catal.上,江西师范大学硕士研究生杨明和王雪伟为文章共同第一作者。该工作得到了人社部高层次留学人才回国资助计划、国家自然科学基金面上项目和重大研究计划培育项目的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Ynamide-Mediated Macrolactonization
Ming Yang, Xuewei Wang, Junfeng Zhao*
ACS Catal., 2020, DOI: org/10.1021/acscatal.0c00523
导师介绍
赵军锋
https://www.x-mol.com/groups/Zhao_Junfeng
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号