Pd催化的不对称C-H活化:手性二茂铁衍生物的合成
二茂铁是历史上首个金属茂基配合物,具有芳香性,其衍生物在医药、材料等领域应用广泛。手性二茂铁衍生物在不对称催化领域中发挥着重要作用。目前,手性二茂铁衍生物的合成主要有以下途径:(1)消旋二茂铁衍生物的手性拆分(chiral resolution),如Fu催化剂的合成(Figure 1A);(2)手性辅基的诱导的非对映选择性官能化,如Josiphos的合成(Figure 1B);(3)不对称催化,理论上最高效的方法,但是目前报道较少[1]。
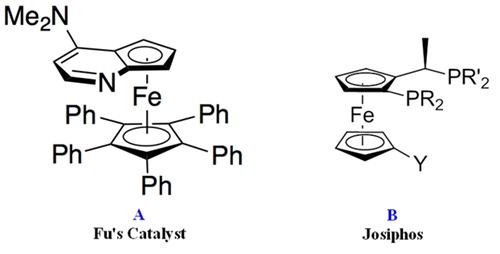
Figure 1.手性二茂铁衍生物(图片来源:wikipedia)
芳基化是Pd催化的sp2 C-H活化中研究的较多、较成熟的反应之一。当二茂铁具有单一的可以作为导向基团取代基时,如果能够实现邻位芳基化反应,二茂铁骨架便产生了平面手性(Scheme 1)。

Scheme 1. Pd催化的芳香烃的sp2 C-H芳基化反应
手性氨基酸配体是C-H活化领域的超级大牛余金权教授(具有超高的H-index和Hair-index)的代表作之一,它在Pd催化的C-H活化中具有双重作用:(1)配体加速效应,使反应可以在较温和的条件下进行;(2)为反应的立体控制提供了可能性。(余金权教授课题组主页:http://www.scripps.edu/yu/#ad-image-0)
受此启发,上海有机化学研究所的游书力研究小组设想将Pd(II)/手性氨基酸催化体系用于手性二茂铁衍生物的合成[2]。研究人员以胺甲基二茂铁和苯基硼酸为模板底物,10 mol%的Pd(OAc)2为催化剂,筛选了多种L-氨基酸作为手性配体。最后发现,当使用20 mol%的Boc保护的L-缬氨酸为配体时,反应可以得到79%的收率,98% ee。随后的底物适用性研究表明,不同取代的芳基硼酸均可以很好的参与该反应,得到90%以上的ee值(Scheme 2);当使用烷基硼酸(如甲基硼酸)时,反应收率急剧下降(仅14%)。
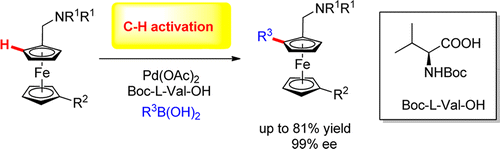
Scheme 2. Pd/手性氨基酸催化合成手性二茂铁衍生物(图片来源:J. Am. Chem. Soc., 2013, 135, 86–89)
从其中的一个产物(Sp)-3n出发,只需一步反应便可以得到手性膦配体(Sp)-L1,用于丙二酸甲酯与烯丙基醋酸酯的烯丙基化反应时,尽管其立体选择性控制不尽如人意(15% ee),却也至少提供了二茂铁骨架膦配体合成的一种新途径(Scheme 3)。
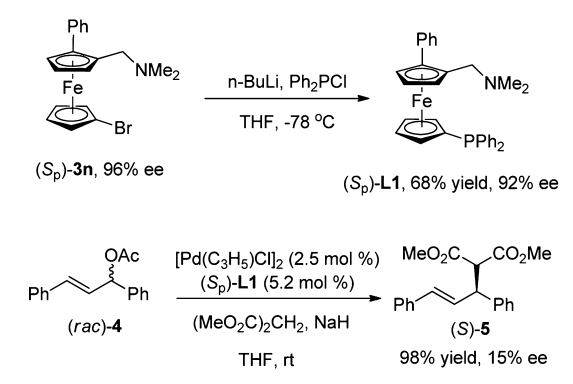
Scheme 3.手性二茂铁膦配体的合成及应用(图片来源:J. Am. Chem. Soc., 2013, 135, 86–89)
相比于上述芳基硼酸参与的C-H芳基化反应,两个芳香化合物的直接C-H/C-H偶联反应具有完美的原子经济性。基于这种考虑,游书力研究小组将芳基硼酸换为非官能化的富电子芳基化合物(利于第二重C-Pd键的区域选择性形成),以双C-H活化的方式实现了系列手性二茂铁衍生物的高效合成[3]。模板反应使用10 mol%的Pd(OAc)2,20 mol% Boc保护的L-异亮氨酸,在10 mol%苯醌/空气条件下,以71%的分离收率,99%的ee值得到偶联产物(Scheme 4)。
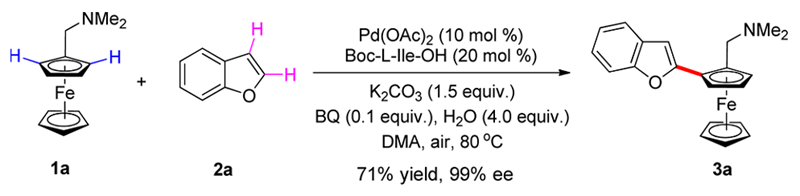
Scheme 4. Pd催化的不对称C-H/C-H偶联反应合成手性二茂铁衍生物(图片来源:J. Am. Chem. Soc., 2016, 138, 2544–2547)
具有不同取代基的二茂铁,如醛,叔醇,三甲基硅基等,都可以很好的参与反应,ee值高达99%(Scheme 5)。
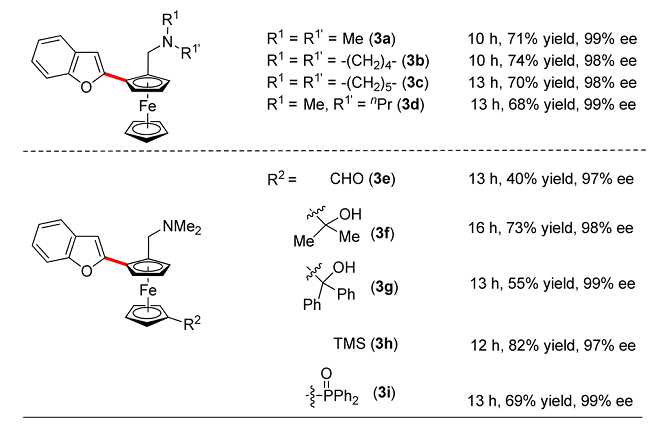
Scheme 5. 不同取代的二茂铁参与的不对称C-H/C-H偶联反应(图片来源:J. Am. Chem. Soc., 2016, 138, 2544–2547)
多种非官能化的芳香环类化合物(如苯并呋喃、呋喃、噻吩、吡咯、吲哚等)参与的不对称C-H/C-H直接反应也都可以稳定地得到目标产物,收率和ee值分别高达86%和99%(Scheme 6)。
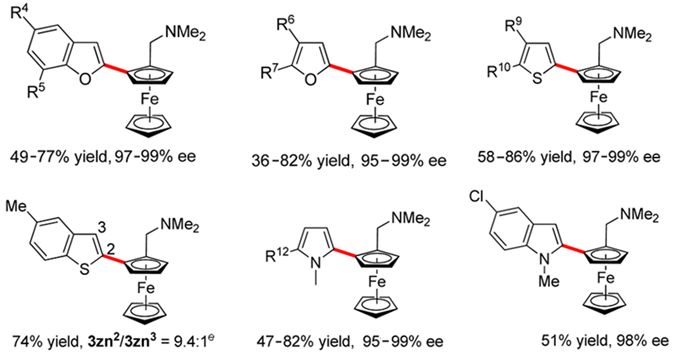
Scheme 6. 富电子芳杂环参与的不对称C-H/C-H偶联反应(图片来源:J. Am. Chem. Soc., 2016, 138, 2544–2547)
Pd(0)与卤代物等发生氧化加成,生成的Pd(II)中间体也可以参与惰性C-H键的活化。基于此策略,游书力研究小组[4]和中国科学技术大学的顾振华教授小组[5],于2013年,同时独立报道了Pd(0)催化的二茂铁衍生物的不对称合成。两篇报道的底物都是邻位卤代的二芳基酮类化合物,只是碘代与溴代的区别;催化体系均为Pd(OAc)2/BINAP,产物的ee值均在90%以上,不同的是游书力小组报道的反应钯催化剂用量较低(2.5% vs 5%),缺点是反应时间也相应的延长(Scheme 7)。
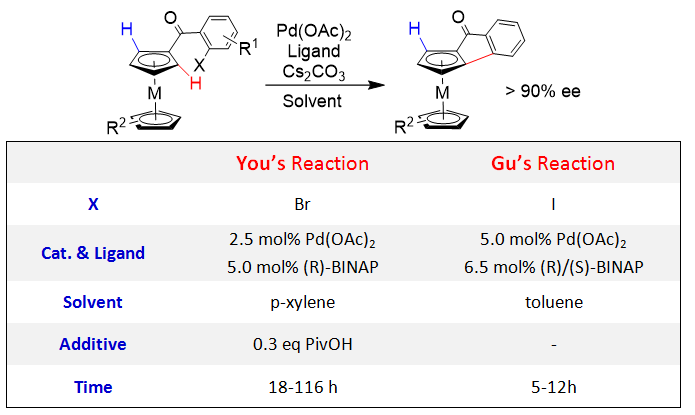
Scheme 7. 两组类似反应的最优条件比较
除此之外,顾振华小组报道的反应重点考察了茂基金属化合物的普适性,包括二茂铁取代基(包括含手性中心的官能团)和二茂钌类化合物(Scheme 8A)[5];而游书力小组的反应在考察了底物的适用性之后,利用产物已有的官能团进行巧妙的衍生,合成了新型的手性氮-膦配体(Scheme 8B)[4]。

Scheme 8. 两组类似反应的不同侧重点比较(图片来源:J. Am. Chem. Soc., 2014, 136, 4841–4844;J. Am. Chem. Soc., 2014, 136, 4472–4475)
结语:
二茂铁的特殊结构与性质决定了其官能化的局限性,其中C-H活化的途径具有完美地原子经济性和步骤经济性,而以不对称C-H活化的方式构建二茂铁的平面手性尤其难得可贵。
参考文献:
1. Enantioselective Synthesis of Planar-Chiral Phosphaferrocenes by Molybdenum-Catalyzed Asymmetric Interannular Ring-Closing Metathesis. J. Am. Chem. Soc., 2010, 132, 2136–2137.
http://pubs.acs.org/doi/abs/10.1021/ja910348z
2. Enantioselective Synthesis of Planar Chiral Ferrocenes via Palladium-Catalyzed Direct Coupling with Arylboronic Acids. J. Am. Chem. Soc., 2013, 135, 86–89.
http://pubs.acs.org/doi/abs/10.1021/ja311082u
3. An Enantioselective Oxidative C–H/C–H Cross-Coupling Reaction: Highly Efficient Method To Prepare Planar Chiral Ferrocenes. J. Am. Chem. Soc., 2016, 138, 2544–2547.
http://pubs.acs.org/doi/abs/10.1021/jacs.6b00127
4. Enantioselective Synthesis of Planar Chiral Ferrocenes via Pd(0)-Catalyzed Intramolecular Direct C–H Bond Arylation. J. Am. Chem. Soc., 2014, 136, 4841–4844.
http://pubs.acs.org/doi/abs/10.1021/ja500444v
5. Palladium-Catalyzed Intramolecular Asymmetric C–H Functionalization/Cyclization Reaction of Metallocenes: An Efficient Approach toward the Synthesis of Planar Chiral Metallocene Compounds. J. Am. Chem. Soc., 2014, 136, 4472–4475.
http://pubs.acs.org/doi/abs/10.1021/ja500699x
(本文由岐黄柚子茶供稿)
