AD蛋白质的“化学易容术”
各位读者想必对阿尔茨海默症(Alzheimer disease,AD)不陌生,这是一种困扰着全球千万患者的严重疾病。阿尔兹海默症是一种神经退行性疾病,临床上以记忆障碍、失语、人格和行为改变等表现为特征,民间也俗称它为“老年痴呆症”,但小氘并不推荐使用这种略带侮辱性的名称。阿尔兹海默症不会马上要人命,但严重患者基本丧失生活自理能力,最令人难以接受的是对亲人的遗忘,这对老年人的生活质量和预期寿命有着极大威胁。
随着全球老龄化的加剧,阿尔茨海默症的患病率也持续上升。据统计,2015年时全球已有4680万患者,每3秒就会增加一名患者。我国确诊的阿尔茨海默症为600多万,再过几年可能要超过千万。[1]
图片来源于网络
那么,阿尔茨海默症的病因到底是什么呢?目前比较公认的解释是人类大脑中积累了太多β-淀粉样蛋白(Aβ),形成沉淀核心,产生神经毒性,诱导神经系统炎症和细胞坏死。另一种假说是微管相关蛋白tau蛋白结构异化导致其在神经细胞内积累,阻碍神经系统的正常功能。据此,大批药企和研究机构纷纷以β-淀粉样蛋白或tau蛋白为靶点研发治疗阿尔茨海默症的新药,其中不乏辉瑞、强生、礼来这样的国际巨头,可惜纷纷折戟沉沙,未能从三期临床试验脱颖而出。坊间有句玩笑说,“没做黄过阿尔茨海默症新药,都不好意思称自己是大药企”。
对于这些失败,小氘认为要背锅的并不是这些大药企的研发能力,更有可能的原因是我们对疾病的理解还远远不够。最近,加州大学河滨分校的Ryan R. Julian课题组报道了他们对阿尔茨海默症病因的新理解。他们发现β-淀粉样蛋白在特定位点会发生自发性化学修饰,使自身难以被溶酶体中的蛋白酶降解。这使得β-淀粉样蛋白得以积累,从而诱发阿尔兹海默症。
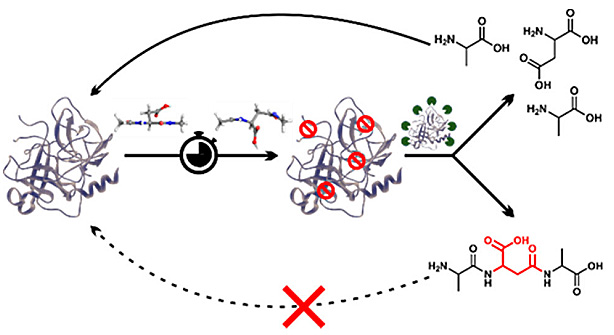
图片来源:ACS Cent. Sci.
人体每时每刻都有无数的蛋白诞生以行使功能,同时也有无数的蛋白被降解,如此循环往复维持动态平衡。溶酶体位于细胞中,含有多种蛋白酶。我们知道,酶的特异性很强,某些蛋白机缘巧合下发生了一些非受控的结构修饰,可能就难以被原来的酶特异性识别并降解。尤其是那些寿命很长的蛋白质,发生这种非受控修饰的机会更高。这就好比武侠小说中的“易容术”,长寿命蛋白质都深谙此道,以躲避溶酶体蛋白酶的“追杀”。
蛋白质修饰有很多种形式,比如官能团的氧化、还原、偶联其他官能团等。其中,可自发进行的异构化(isomerization)和差向异构化(epimerization)是长寿命蛋白质中比较常见的形式。蛋白质的异构化主要与天冬氨酸(Asp)有关,天冬氨酸侧链上还有一个羧基,在某些情况下也能与其他氨基酸的氨基形成酰胺键连接,从而插入蛋白质的主肽链中。而差向异构化只是氨基酸侧链的手性发生变化,例如从L构象变成D构象。L型氨基酸和D型氨基酸互为镜像对称,长得一模一样,只是手性变了。目前已知地球上生命体中的氨基酸都是L型氨基酸,这样意味着一旦与阿尔茨海默症密切相关的Aβ和tau蛋白的一些天冬氨酸变成D型,原本可以降解它的蛋白酶就会失效。
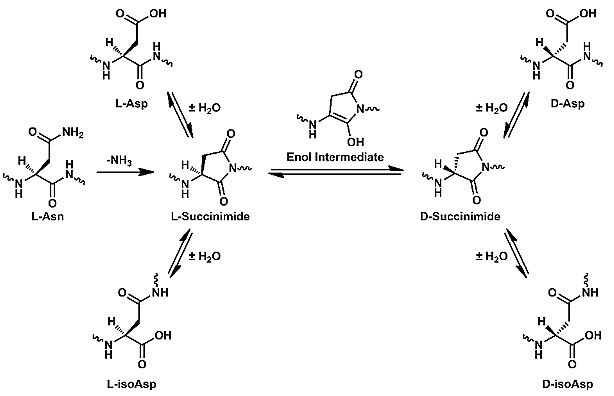
L-天冬氨酸自发性构象变化过程。图片来源:ACS Cent. Sci.
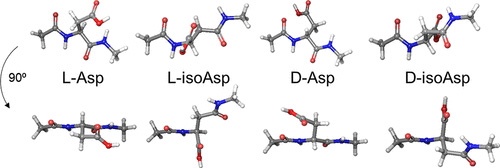
天冬氨酸结构模型。图片来源:ACS Cent. Sci.
Ryan Julian等人研究发现,Aβ和tau蛋白都会“易容”,通过异构化和差向异构化阻止溶酶体中的蛋白酶对它们的降解。
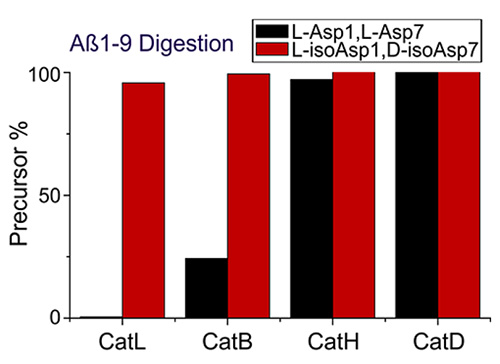
Aβ1-9肽的1位和7位天冬氨酸发生修饰后被降解比例的变化。图片来源:ACS Cent. Sci.
研究人员在小鼠神经细胞中观察到了这种长寿蛋白的产生。荧光染料会指示被降解的Aβ。从荧光实验可以看出,发生化学修饰后的Aβ几乎不会被降解。从分子层面,D型天冬氨酸也不再适应蛋白酶的活性中心口袋。这意味着蛋白酶已经无法认出“易容”后的Aβ,降解也就无从谈起。
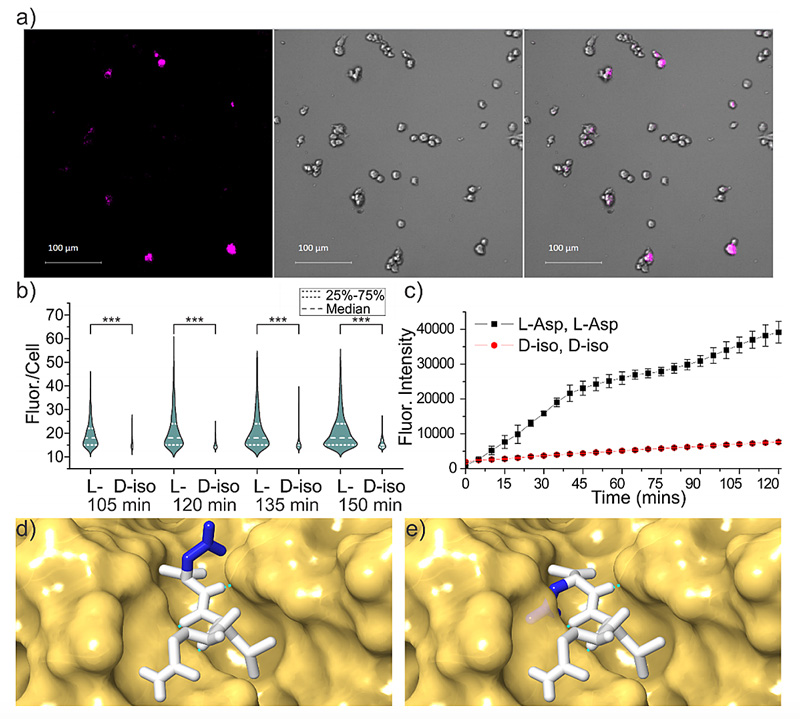
在小鼠神经细胞中发生的Aβ结构变化。图片来源:ACS Cent. Sci.
那些原本会被降解的Aβ和tau蛋白由于发生了这种细微的变化无法被降解,只能留在溶酶体中,医学上称这种现象为溶酶体贮存,常见于阿尔茨海默症患者脑中。不过这种变化毕竟是概率较低的自发性反应,需要很长时间才可能有足够多的修饰Aβ和tau蛋白贮存于溶酶体中。研究人员也在实验中证明了这一点,时间越久,这种结构变化发生率越高。这也与阿尔茨海默症发病率与年龄密切相关的事实吻合。
这项研究无疑为阿尔茨海默症的病理研究和药物研发提供了新思路。如果能够开发一种药物帮助溶酶体消除这些“长寿”的Aβ和tau蛋白,或许人们就不再对阿尔茨海默症的治疗感到那么糊涂了。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Spontaneous Isomerization of Long-Lived Proteins Provides a Molecular Mechanism for the Lysosomal Failure Observed in Alzheimer's Disease
Tyler R. Lambeth, Dylan L. Riggs, Lance E. Talbert, Jin Tang, Emily Coburn, Amrik S. Kang, Jessica Noll, Catherine Augello, Byron D. Ford, Ryan R. Julian
ACS Cent. Sci., 2019, 5, 1387-1395, DOI: 10.1021/acscentsci.9b00369
参考资料:
1、《世界阿尔茨海默病报告2016——改善痴呆患者的医疗保健:目前以及未来的覆盖率、质量和成本》,国际阿尔茨海默病协会(ADI)
(本文由氘氘斋供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号