仿生接力催化苯酚-吲哚高对映选择性[3+2]氧化环化合成手性苯并呋喃并吲哚啉
酚的氧化是自然界普遍存在的重要生命过程,例如有氧细胞呼吸的Q循环。酚的选择性氧化同样也参与了许多生物活性次级代谢物的合成。其中,酚与吲哚的酶促氧化[3+2]环化反应是bipleiophylline等多种生物碱吲哚衍生物的生物合成路径中的关键步骤。而这一环化过程由于涉及到两种亲核试剂的氧化偶联,要同时控制化学选择性、区域选择性和立体选择性对于化学催化剂具有显著的挑战。醌类分子是一类高活性的重要有机合成子,其不对称催化转化反应近年来也层出不穷。然而因其较低的稳定性,这些反应主要限于使用可制备分离的1,4-醌类化合物和N-Ts醌亚胺。后者的活性很高,作为亲电试剂被广泛用于不对称催化合成,但是仍然存在着几个缺点:制备产率较低、容易水解、不易保存;催化剂用量较高;Ts基团也较难脱去,不利于产物的衍生应用。在生命体中,酪氨酸酶、漆酶、过氧化物酶等通过金属辅酶催化氧化酚生成醌中间体,而后被亲核物种捕获,例如天然生物碱分子bipleiophylline就是通过儿茶酚氧化酶与酸的接力催化生物合成的(图1a)。已知的酚与吲哚的氧化环化偶联反应是基于FeCl3/DDQ、高价碘、Ag2O等金属氧化物(图1b)。这些方法虽然有效,但是尚未见对映选择性的报道。
近日,华中科技大学化学与化工学院钟芳锐教授课题组发展了仿生接力催化苯酚-吲哚高对映选择性[3+2]氧化环化方法,在温和条件下合成手性苯并呋喃并吲哚啉。该方法以酚类为前体底物的原位氧化-接力催化反应的策略,以金属氧化催化剂和TBHP绿色终端氧化剂为组合,实现了高效的酚-吲哚[3+2]环加成反应并获得了优异的化学选择性、区域选择性和立体选择性(图1c)。这一接力催化的策略有效克服了醌的有机反应中底物局限、步骤和原子经济性差等问题,拓展了其在构建多样性手性分子骨架中和合成高附加值功能分子中的应用,进一步了丰富经典醌化学的内涵。

图1. 酚-吲哚氧化偶联的不同策略。图片来源:ACS Catal.
该反应具有良好的底物范围普适性(图2)。吲哚苯环上4位和7位都能容忍多种取代基。2,3-二取代吲哚也能顺利得到目标产物,提供2个手性中心的苯并呋喃吲哚啉。除此之外,当吲哚3位取代是乙基、异丙基、环己基、OTBS时,反应产物也能得到很高的ee值(3k, 3l, 3p−3r, 91%-96% ee)。对于氨基苯酚,当使用氨基甲酸乙酯、N-Fmoc和Ts-和Cbz保护的氨基酚,对应产物的收率和选择性都基本保持不变,显著地拓展了醌亚胺作为合成子的结构多样性。
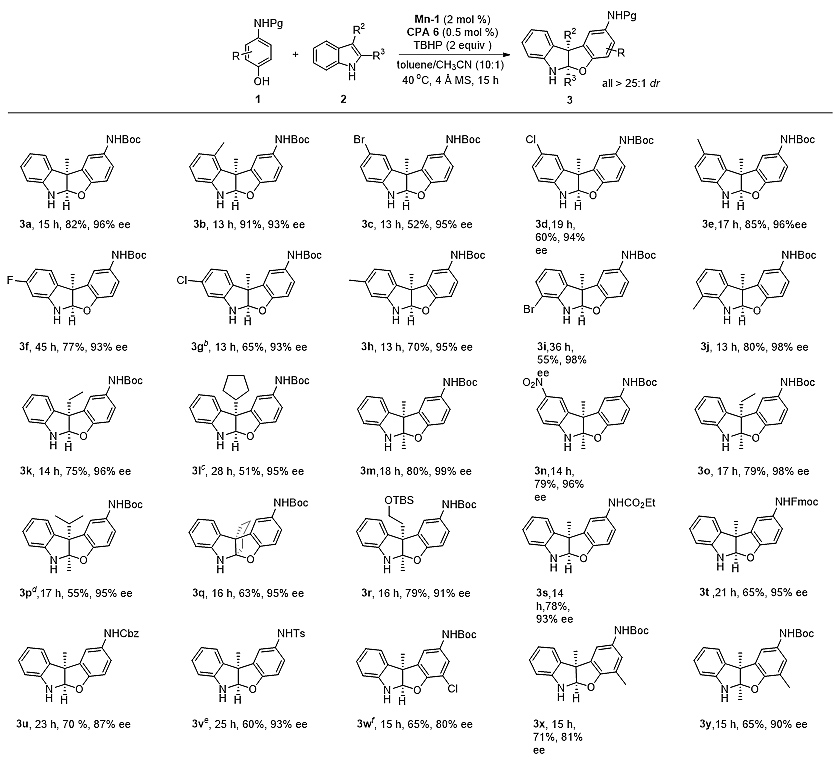
图2 底物范围考察。图片来源:ACS Catal.
值得强调的是,以上大部分底物都是基于0.5 mol%催化剂用量实现的。进一步通过降低催化剂CPA的量至0.05 mol%,依旧能以61%的收率和95% ee分离得到产物3a。在此条件下,克级反应可以顺利地进行。该方法只需要1.88 mg的CPA催化剂A6,便可以生成1.03克目标产物,充分体现了催化体系的优异性。催化剂的用量甚至可以降至0.01 mol%,对映选择性依旧可达89% ee,TON达到4100(图3)。

图3. 降低催化剂的量和克级反应。图片来源:ACS Catal.
由于底物中苯胺氮上的保护基团是Boc,产物3a可以在TFA/DCM条件下容易脱去Boc,中间体不需要分离即可直接与异硫氰酸酯反应生成硫脲衍生物4,也可以与氨基酸通过成熟的偶联试剂生成肽类分子5,而该过程不影响手性中心的对映体纯度(图4)

图4. 产物3a的衍生化。图片来源:ACS Catal.
虽然Salen-Mn(III)和手性磷酸的离子对催化机理在List小组的前期研究中已经报道 (Angew. Chem. Int. Ed., 2010, 49, 628),但磷酸阴离子取代Salen-Mn(III)中的氯离子一般需要碱性条件,所以离子对的形成在当前反应中可能性较小,而Mn-1和手性磷酸A6在催化剂当量上的巨大差异也间接证明了这一点,同时也说明了酸催化剂对Mn催化氧化这一步的干扰可以忽略不计。然而,Mn-1作为Lewis酸对反应的立体选择性的影响却值得探究。作者开展了一系列控制实验(图5),发现模型反应在标准条件下除去手性磷酸A6时,产物3a的产率只有5%,但如果使用手性的Mn-2催化剂(R,R-Jacobsen catalyst),产物3a确实有可观的立体选择性(10%ee)。这说明手性Salen-Mn(III)催化了立体选择性决定步骤的进行并在对应过渡态中与底物有作用。然而,一旦反应中加入手性磷酸催化剂A6(即使只用0.1 mol%),产物3a的对映体纯度与非手性的Mn-1组合时一致(96% ee),而与相反构型ent-Mn-2催化剂(S,S-Jacobsen catalyst)组合的结果也没有区别(图5a)。这些实验结果说明了对于立体选择性决定步骤,手性磷酸催化的速率远远超过Mn催化,两种催化剂的构型匹配问题可以忽略不计。仔细分析反应液,作者发现,在不加入磷酸A6的情况下,通过核磁和质谱观察到了N-Boc对苯醌亚胺中间体的生成,而一旦加入A6(0.25 mol%),该中间体就难以观察到,这一现象也证明了上述结论。另外,如果使用化学计量的氧化剂如Ag2O和手性磷酸A6组合,在类似的条件下(图5b),产物3a的产物和立体选择性都显著降低(15% yield,10% ee),这可能是大量迅速产生的不稳定中间体分解和化学计量的Ag金属对手性诱导的干扰引起的,而这也说明了接力催化策略通过调控反应动力学过程控制高活性亚稳醌中间体活性的重要性、必要性和优越性。
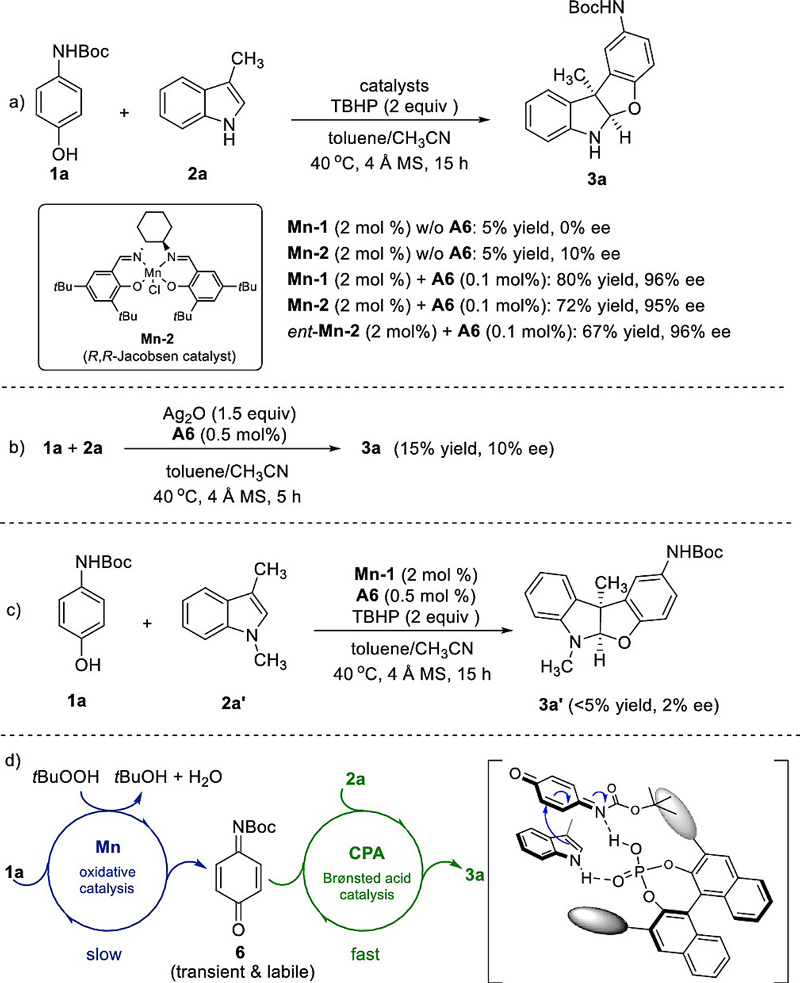
图5. 控制实验和反应机理推测。图片来源:ACS Catal.
当吲哚NH被甲基化时,底物2a'在标准条件下的产物和选择性都显著降低(图5c,<5% yield,2% ee),这说明了磷酸A6可能与吲哚NH形成了氢键作用活化底物,并控制反应的立体化学。基于以上实验结果,作者提出了可能的反应机理和过渡态(图5d)。N-Boc氨基酚1a在Mn-1和TBHP的催化氧化下生成了高活性亚稳醌中间体6,该中间体可能和吲哚2a与磷酸A6同时形成氢键作用,提高了反应活性的同时实现了环加成步骤的立体化学控制。相比之下,催化氧化的过程比较慢,而酸催化环加成的过程比较快,产生的亚稳醌亚胺才被有效快速的捕获。
综上所述,该项研究通过仿生Salen-Mn(III)和手性磷酸CPA的接力催化,首次实现了苯酚-吲哚[3+2]的直接对应选择性氧化偶联反应,获得了有价值的光学纯苯并呋喃二氢吲哚类化合物。通过苯酚氧化酶的仿生催化,该研究提供了一种酚和吲哚类底物的不对称接力催化氧化偶联新策略,其优势包括催化剂经济性、原子和步骤经济性和显著扩宽的醌亚胺适用性。这一策略有望用于廉价易得的酚类化合物参与的其它不对称氧化偶联反应,从而快速构型多样性复杂手性分子。
该研究工作近期发表在ACS Catalysis 上。主要实验部分由硕士研究生余其乐完成,钟芳锐教授和吴钰周教授是本文的共同通讯作者。该研究工作得到了国家自然科学基金的资金资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective Oxidative Phenol-Indole [3+2] Coupling Enabled by Biomimetic Mn(III)/Brønsted Acid Relay Catalysis
Qile Yu, Yu Fu, Jianjian Huang, Jingyang Qin, Honghua Zuo, Yuzhou Wu, Fangrui Zhong
ACS Catal., 2019, 9, 7285-7291, DOI: 10.1021/acscatal.9b01734
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号