Nature:高价碘用于蛋白质的选择性标记
都说“21世纪是生命科学的世纪”,越来越多化学家加入到生命科学研究中,化学诺奖也频频颁给生命科学领域,化学生物学也成了发展日新月异的二级学科。蛋白质很早就成为化学生物学的焦点,原因之一是蛋白质上有丰富多样的化学基团,正是它们丰富多样的性质及其在蛋白链上的序列决定了蛋白质的功能。实际上,细胞中一些蛋白质在合成后,还有会系统对其中一些特定基团进行修饰(例如在氨基上接上甲基或者乙酰基),进一步调节该蛋白的活性,称之为“翻译后修饰”。科学家们由此想到,是否能人为在特定的位点对蛋白质进行修饰,以标记、研究和调控蛋白质的时空分布,代谢和活性等等。
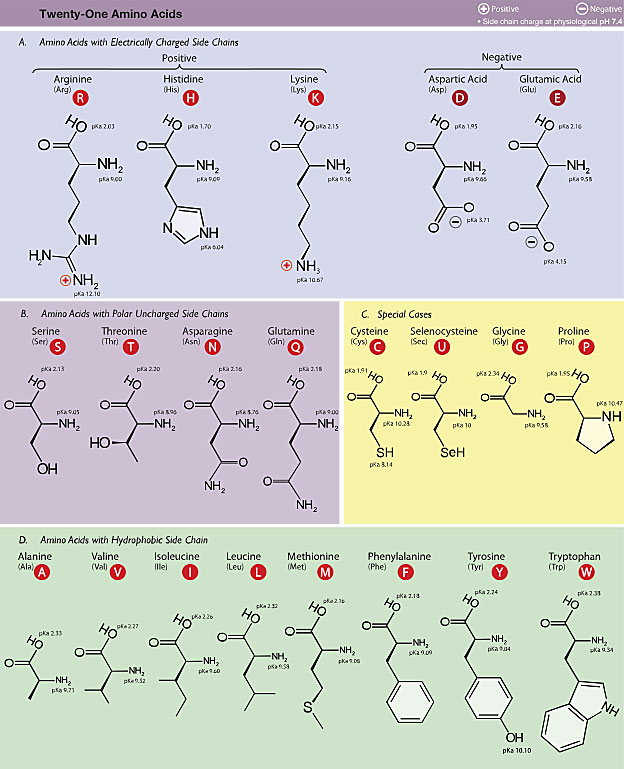
图1. 21种常见氨基酸。图片来源:wikipedia
但这其实很难,要求反应能在细胞环境下进行(限制了反应条件和试剂毒性),同时反应的选择性高、反应速率快、转化率高。看看常见的21种氨基酸,不难发现,从有机化学的角度,最容易进行修饰的也就是巯基(半胱氨酸)、氨基(赖氨酸)和酚羟基(酪氨酸)。实际上,此前对蛋白进行化学修饰的着手点也正是这些位点。毫无疑问,拓展基于其他基团的修饰策略会极大的拓宽蛋白质化学修饰的适用范围,特别是考虑到上述的几种化学基团通常也都直接关系到蛋白质的功能,在这些位点上的反应可能会永久破坏蛋白质活性。
蛋氨酸由此引起关注。这是一种含量相对较少的(2%)的氨基酸,通常也不涉及蛋白质活性,主要功能只是提高蛋白的抗氧化能力(硫醚具有一定的还原性),因而在该位点的反应更适合用来对蛋白进行化学标记。利用蛋氨酸的弱还原性,在2017年的Science上,来自加州大学伯克利分校的F. Dean Toste教授和Christopher J. Chang教授领导的团队报道了一种带有氧化性的有机试剂氧氮丙啶,能够选择性地和硫醚反应生成亚磺酰亚胺(Science, 2017, 355, 597)。
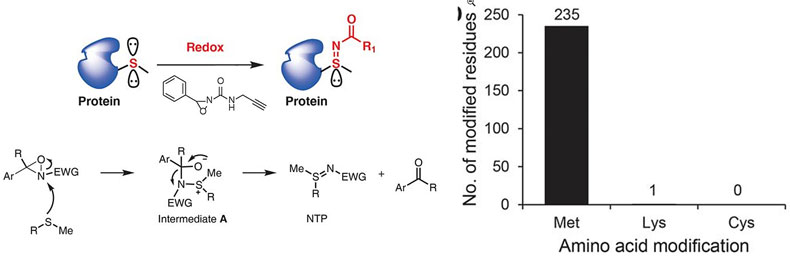
图2. 氧氮丙啶与硫醚形成亚磺酰亚胺,实现对蛋氨酸的选择性标记。图片来源:Science
蛋氨酸有没有其他反应模式呢?从有机化学的角度出发,不难预期,硫醚可以有一定的亲核性,但这种亲核性实际相当弱,特别是和半胱氨酸上的巯基一比。不过在一篇2013年的Chem. Commun.上,Timothy J. Deming课题组报道了一种基于烷基化(亲核反应)的蛋白质标记策略。使用相对简单的亲电试剂,他们就能选择性的和蛋氨酸上的硫醚而不是半胱氨酸上的巯基或者赖氨酸上的氨基反应(而且还是可逆的)(Chem. Commun., 2013, 49, 5144)。
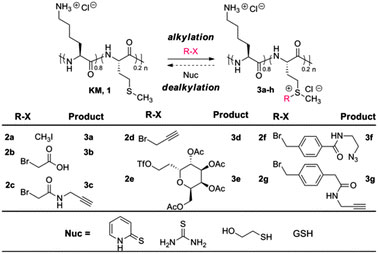
图3. 筛选合适的对蛋氨酸进行烷基化的反应物,2g 效果最佳。图片来源:Chem. Commun.
在Timothy J. Deming课题组报道的这个策略中,虽然得到的产物硫鎓是相对稳定的,但反应非常慢,不适用于细胞环境下的蛋白标记。近期,剑桥大学的Matthew J. Gaunt(点击查看介绍)课题组在Nature上报道了一种基于高价碘试剂的亲核反应用于蛋氨酸标记,反应能在水相中迅速高效完成,并且得到的产物由于带有重氮锍结构,因而不仅能在高价碘试剂中引入特定化学基团(下图R3基团),还能通过后续的光化学反应进行二次修饰,拓展了一种新的蛋白修饰模式。
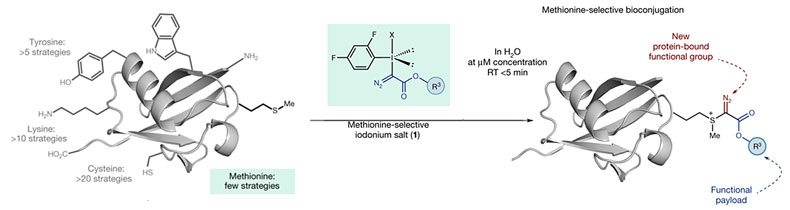
图4. 基于高价碘试剂的蛋氨酸选择性标记策略。图片来源: Nature
实际上,关于高价碘试剂的研究并不是太新鲜的事情,这类试剂能和弱的亲核试剂反应,包括最简单的硫醚——二甲基硫醚。
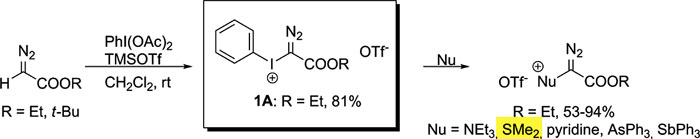
图5. 高价碘试剂和硫醚反应生成锍。图片来源:J. Org. Chem., 2013, 78, 7488
不过即便如此,将这类反应用于蛋氨酸的选择性标记仍然不是一蹴而就的。在最早的实验中,由于高价碘试剂1a在水中不稳定,产率还是较低。通过改变取代基以及抗衡阴离子优化后得到的1b,能在30min内将72%的二肽2a转化为目标产物。在用模型蛋白2b开展的实验中,作者进一步优化了实验条件:在体系中添加硫脲和氮氧自由基TEMPO。

图6. 用二肽和简单蛋白进行反应条件的优化。图片来源:Nature
在随后的底物拓展中,作者尝试了不同的蛋白质,以及带有不同基团的高价碘试剂,反应都能高效的进行。值得一提的是,像此前的Chem. Commun.那篇工作一样,这里的修饰也是“可逆”的。
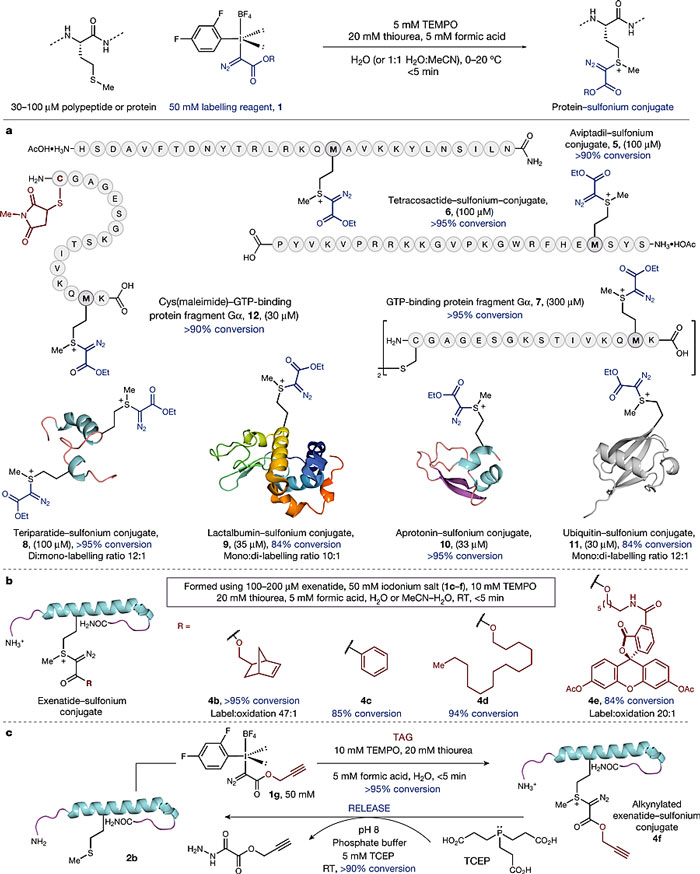
图7. 拓展反应的底物以及逆反应。图片来源:Nature
注意到,产物重氮锍的结构其实是很特别的,作者在体系中加入可见光光催化剂诱发重氮锍的单电子转移反应,经过自由基中间体,在和额外添加的Hantzsch酯反应后,得到较为稳定的硫鎓。如果Hantzsch酯上有取代基,可以得到相应的取代硫鎓(二次修饰)。
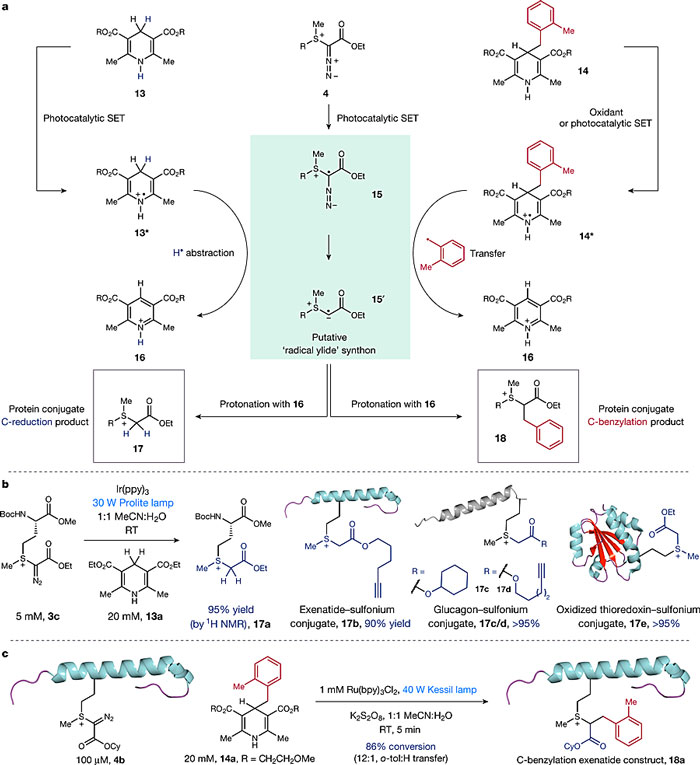
图8. 重氮锍的光化学反应、机理、底物拓展和二次修饰的示例。图片来源:Nature
相比赖氨酸、半胱氨酸等位置,蛋氨酸上的选择性标记对蛋白质活性影响较小,但难度也更大。过去最成功的策略是利用蛋氨酸的还原性,让氧氮丙啶试剂与硫醚形成亚磺酰亚胺实现标记;在这篇工作中,作者注意到高价碘试剂和硫醚的反应性,通过优化反应条件,高效得到以重氮锍结构为特征的产物,并且兼容多种化学基团;并进一步开发重氮锍结构的光化学反应,实现蛋白质的二次修饰。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A protein functionalization platform based on selective reactions at methionine residues
Nature, 2018, 562, 563–568, DOI: 10.1038/s41586-018-0608-y
导师介绍
Matthew J. Gaunt
http://www.x-mol.com/university/faculty/2561
课题组链接
https://www.thegauntgroup.com/mjg
(本文由荷塘月供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号