基于Cu2MoS4多功能级联生物反应器的抗肿瘤协同治疗
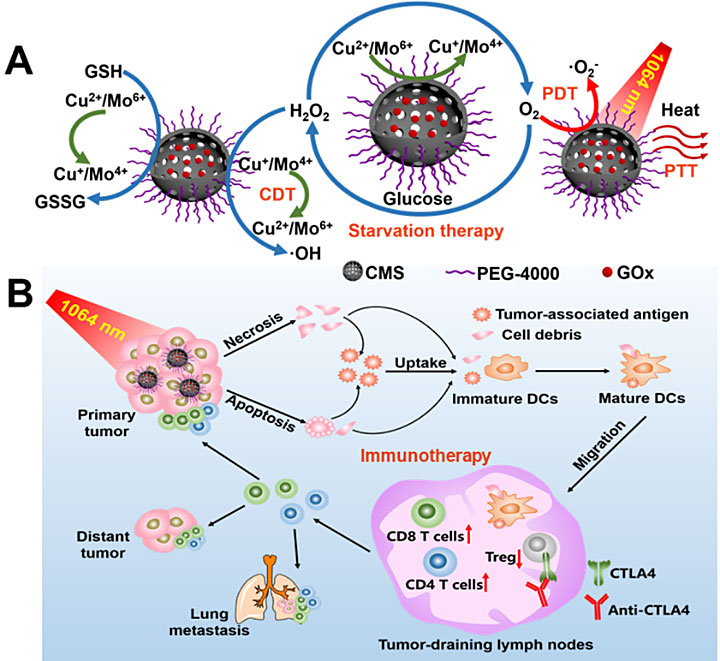
目前,应用于临床的手术、化疗和放疗等传统癌症治疗方法虽然可以有效地抑制原发肿瘤的生长。但是将近90%的与癌症相关的死亡是由于癌细胞扩散造成的。原发肿瘤的定点精准抑制辅以转移性肿瘤的全身治疗是彻底清除体内癌细胞实现肿瘤根治的理想策略。作为一种非浸润性的肿瘤消融手段,光热治疗在不损伤正常组织的情况下可以有效地杀伤癌细胞实现对原发肿瘤的有效清除。免疫治疗能够刺激患者固有的免疫系统并恢复机体正常的抗肿瘤免疫反应,通过重新启动并维持肿瘤-免疫循环来控制肿瘤原发病灶并可同步清除全身转移癌细胞。光热治疗诱导原发病灶中死亡的癌细胞释放肿瘤相关抗原,树突状细胞可以捕获这些抗原,并迁移到脾脏和淋巴结等免疫器官。随后,这些抗原通过主要组织相容性复合体的形式被提呈给T细胞接收器,并启动T细胞介导的癌症免疫。因此,设计一种能激发肿瘤免疫应答的智能“疫苗类纳米光热治疗剂”,对已经发生转移的肿瘤治疗具有重要的意义。
实体肿瘤具有免疫抑制微环境,这与其独特的肿瘤微环境相关,其特征包括:乏氧、高浓度过氧化氢、谷胱甘肽过表达等。这种独特的肿瘤微环境可促进肿瘤的增殖和转移,使得单一疗法很难能彻底治愈癌症。近年来,纳米酶作为一种具备酶学活性的纳米材料,其催化活性可与天然酶相媲美,但比天然酶更加稳定,并且具有多功能、可规模化制备、成本较低等特点,已成为多学科交叉研究的前沿热点。其中,基于可变价金属离子(如Fe2+/3+、Cu+/2+、Mn2+/4+)催化反应构建的纳米酶可有效调节肿瘤微环境并提高抗肿瘤治疗效果。因此,构建具有纳米酶活性的疫苗类纳米光热治疗剂可以提供一种具有肿瘤微环境调制能力的联合治疗方式,对根治原发性肿瘤和同步抑制癌症转移至关重要,也是实现协同抗癌治疗的关键。
中国科学院长春应用化学研究所林君研究(点击查看介绍)员团队联合广州医科大学侯智尧教授(点击查看介绍)团队针对上述问题制备了负载葡萄糖氧化酶(GOx)的中空介孔Cu2MoS4(CMS)的多功能级联生物反应器。CMS具有过氧化氢酶活性,可与肿瘤中过量的过氧化氢反应产生氧气,极大程度地缓解肿瘤组织乏氧的情况,增强肿瘤需氧治疗的效率。CMS纳米酶中存在Cu+/ Cu2+和Mo4+/ Mo6+两对氧化还原电对,其可与过氧化氢反应生成高毒性羟基自由基,产生显著的化学动力学疗效。同时,CMS还具有过氧化物酶活性,可消耗肿瘤中过表达的谷胱甘肽,进而破坏肿瘤的抗氧化防御系统,增强化学动力学治疗效率。CMS在整个近红外区域都有很强的吸收,可实现近红外二区1064 nm激光照射下的光热治疗。并且,CMS作为一种窄带隙半导体,在1064 nm激光激发下,可产生超氧阴离子自由基,用于光动力治疗。进一步地,CMS纳米酶中载入GOx,可极大程度地消耗肿瘤内部的葡萄糖,产生协同的饥饿治疗效果。该纳米药物,在结合CTLA4抗体进行免疫治疗时,其可以有效地切除原发肿瘤,并且抑制癌症转移。CMS作为一种具有纳米酶活性的疫苗类纳米治疗剂可实现光学治疗/化学动力学治疗/饥饿治疗/免疫治疗的高效联合治疗,在未来癌症的治疗中CMS本身固有的物化特性可以为应对复杂的肿瘤生理环境和肿瘤患者的个体化差异提供丰富的治疗手段选择。
这一成果近期发表在Advanced Materials 上,文章的第一作者是中国科学院长春应用化学研究所博士研究生常梦宇。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A Multifunctional Cascade Bioreactor Based on Hollow Structured Cu2MoS4 for Synergetic Cancer Chemo-Dynamic Therapy / Starvation Therapy / Phototherapy / Immunotherapy with Remarkably Enhanced Efficacy
Mengyu Chang, Man Wang, Meifang Wang, Mengmeng Shu, Binbin Ding, Chunxia Li, Maolin Pang, Shuzhong Cui, Zhiyao Hou,* Jun Lin*
Adv. Mater., 2019, 31, 1905271, DOI: 10.1002/adma.201905271
侯智尧教授简介

侯智尧,广州医科大学基础医学院南山学者特聘教授,博士生导师。2009年于哈尔滨工程大学获得博士学位,2010年至2018年中国科学院稀土资源利用国家重点实验室工作,2019年起就职于广州医科大学。主要研究方向:针对光能转换材料合成与应用中的基本科学问题,以电子跃迁和稀土离子能量传递为理论基础,结合医学、生物学、材料学和化学等多学科交叉的研究优势,开展新型纳米光能转换材料构建及其在肿瘤光学诊疗中应用的基础研究,实现了多模态影像导航下的近红外光响应抗肿瘤协同治疗;同时开展纳米光能转换材料在牙周相关疾病、神经退行性疾病及骨修复方面的应用研究。目前在Adv. Mater.、ACS Nano、Adv. Funct. Mater.、Small、Biomaterials 等国际学术期刊上以第一/通讯作者身份发表SCI论文37篇。
https://www.x-mol.com/university/faculty/94622
林君研究员简介

林君,中国科学院长春应用化学研究所研究员,博士生导师,国家杰出青年基金获得者,英国皇家化学会会士,科技部重点领域创新团队负责人,中国稀土学会理事,中国稀土学会发光专业委员会主任,Scientific Reports、中国稀土学报(中英文版)和发光学报编委。2002年获得国家杰出青年科学基金;2004年获得国务院政府特殊津贴;2007年入选“新世纪百千万人才工程国家级人选”;2017年入选万人计划“科技创新领军人才”。课题组自2000年以来一直从事纳-微米结构发光材料的控制合成、形态结构和性能调控及其在显示照明及生物医学领域的应用基础研究。在各种稀土发光材料的形貌控制技术、发光薄膜及其图案化技术、特色FED发光材料、多功能稀土上转换发光材料在生物成像和药物控制传递与释放等方面做出了具有原始创新和国际影响的研究工作。曾经/正在承担科技部973项目子课题、国家自然科学基金杰出青年基金项目、重点项目以及若干面上项目和国际合作项目。2009年和2014年分别获吉林省科技进步一等奖和吉林省自然科学一等奖。2014-2017连续四次入选“汤森路透全球材料领域高被引科学家”名录。至今已在国内外核心期刊如Chem. Rev.、Chem. Soc. Rev.、Mater. Today、J. Am. Chem. Soc.、Adv. Mater.、Adv. Funct. Mater.、ACS Nano、Nano Lett.、Chem. Mater. 等上面发表学术论文600余篇,截止目前这些论文共被他人引用35000余次(H指数102);获授权中国发明专利8项。
https://www.x-mol.com/university/faculty/15805
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号