不对称氢化杂环亚胺合成四氢吡咯/吲哚[1,2-α]并吡嗪
1,2,3,4-四氢吡咯[1,2-α]并吡嗪骨架广泛存在于天然产物和生物活性分子中,是一类重要的优势结构单元。含有上述骨架的化合物具有抗衰老、抗过敏、抗心律不齐、抗病毒以及醛糖还原酶的抑制活性等。另外,需要指出的是,1,2,3,4-四氢吡咯[1,2-α]并吡嗪结构单元上的取代基和绝对构型对其药理活性有着非常重要的影响。因此,手性1,2,3,4-四氢吡咯[1,2-α]并吡嗪衍生物的合成得到化学和药物化学工作者的广泛关注,目前已经取得一些重要的进展。
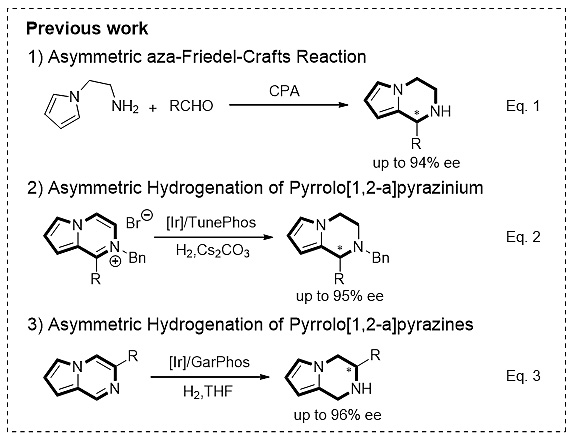
手性1,2,3,4-四氢吡咯[1,2-α]并吡嗪的合成在过去主要是通过底物诱导或者动力学拆分的方法,催化不对称的方法相对较少。2011年,Li和Antilla小组报道了手性磷酸催化的分子内氮杂傅-克反应,对映选择性最高可达94%。2014年,Zhou小组采用底物活化的策略实现了1-取代吡咯[1,2-α]并吡嗪苄溴盐的不对称氢化,ee值最高为95%,反应中需要加入碱抑制产物的消旋化。最近,Zhou小组又实现了吡咯[1,2-α]并吡嗪的直接不对称氢化,并通过氘代实验证明反应先经过3,4-氢化,再经过烯胺-亚胺以及亚胺-亚胺异构化,最后再完全氢化得到3-取代四氢吡咯[1,2-α]并吡嗪。
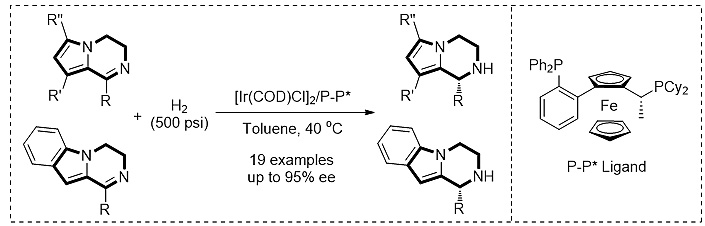
最近,中国科学院大连化学物理研究所的周永贵研究员(点击查看介绍)团队在之前不对称氢化工作的基础上,又实现了3,4-二氢吡咯/吲哚[1,2-α]并吡嗪的直接不对称氢化,用铱的手性双膦配合物作为催化剂在甲苯中反应,对映选择性最高可达95%。在该反应中,手性配体对反应的活性和对映选择性影响很大,使用二茂铁衍生的富电子双膦配体可以得到最好的结果。
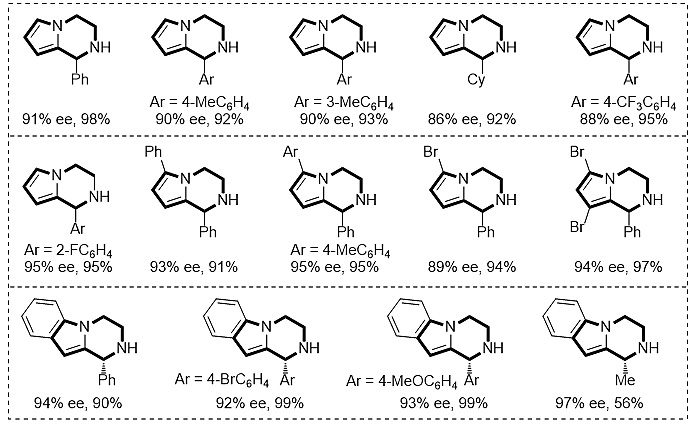
代表性的例子如上图所示,反应表现出良好的底物适用性,该催化体系不仅适用于芳基取代的底物,同时也适用于烷基取代的底物。此外,在吡咯环上引入芳基取代基或者卤素,反应的活性和对映选择性均不会受到明显的影响。该催化体系也适用于3,4-二氢吲哚[1,2-α]并吡嗪底物,芳基取代的底物参与反应对映选择性都比较好,均在90%以上。而当在底物中引入烷基取代基如甲基取代基时,反应仅能取得中等的对映选择性。上述方法提供了一条简洁的途径合成手性的1,2,3,4-四氢吡咯[1,2-α]并吡嗪衍生物。
这一成果近期发表在《化学学报》(Acta Chimica Sinica)上,文章的第一作者是大连化学物理研究所博士研究生胡书博。
该论文作者为:Shu-Bo Hu, Mu-Wang Chen, Xiao-Yong Zhai, Yong-Gui Zhou
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synthesis of Tetrahydropyrrolo/indolo[1,2-α]pyrazines by Enantioselective Hydrogenation of Heterocyclic Imines
Acta Chim. Sinica, 2018, 76, 103, DOI: 10.6023/A17110476
导师介绍
周永贵
http://www.x-mol.com/university/faculty/22800
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号