前言
近年来,细胞力学刺激与响应已被充分证明在微观的细胞铺展、迁移、增殖、分化等行为,以及宏观的胚胎发育、组织形成、疾病发展等至关重要的生物过程中扮演决定性角色。与细胞力刺激相关的刚度、形貌、配体分布等物理性能也因此成为生物材料设计的重要参数。然而,这些静态的物理参数怎样给与细胞力学刺激,细胞又是怎样感受微环境中的机械力学性能,这是一个有趣的话题。
近日,我室在《科学通报》发表评述文章,详细介绍了细胞的力学响应机制,突出了细胞内作用力在细胞力学响应过程中的决定性作用;从分子生物学角度阐述了细胞内力的传递与力学信号转导过程;借此助力生物材料领域学者对细胞与生物材料相互作用的理解,推动细胞与分子生物力学的发展以及新型生物材料的研究与开发。我室赵长生教授、魏强特聘研究员为本文通讯作者,硕士研究生孙骞为本文第一作者。
近年研究表明,细胞对微环境机械力学性能的识别以及机械力的传递与转导主要包括以下几个步骤。
01
蛋白分子链
(Molecular clutch)的组装
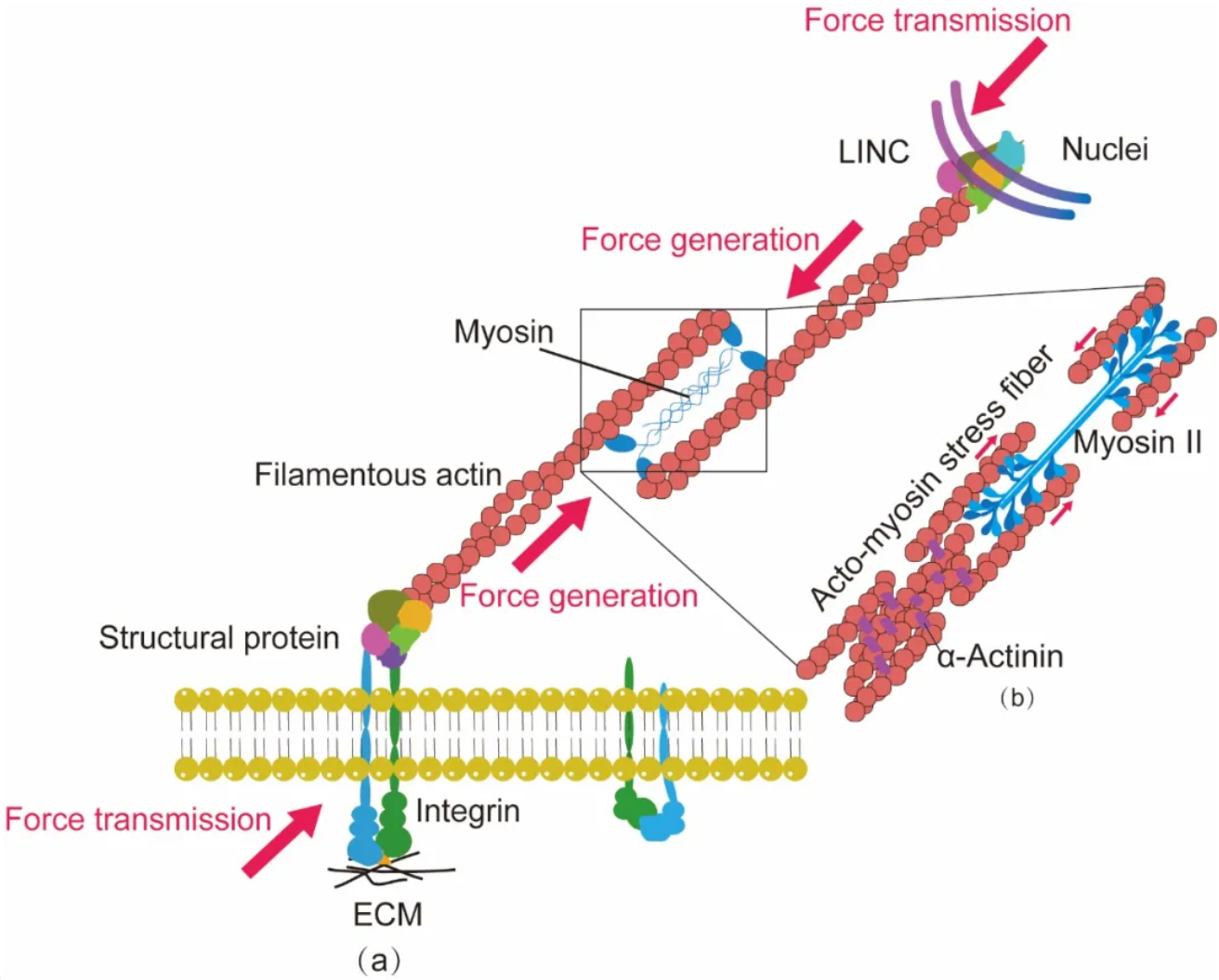
细胞膜上的粘附蛋白,整合素与钙粘蛋白(Cadherin)等,被微环境中配体激活,其胞内结构域(Domain)通过结构蛋白(Structural protein)与纤维状肌动蛋白(Filamentous actin)微丝相连接(图1a)。
02
细胞力的产生与传递
具有活性的肌球蛋白与纤维状肌动蛋白微丝结合(图1b),在交联微丝组成肌动球蛋白丝束骨架的同时,沿着丝束方向产生牵引力。牵引力沿蛋白分子链传递至微环境,微环境产生反作用力以平衡该肌球蛋白牵引力。
03
生化因子信号的激活
肌球蛋白牵引力在蛋白分子链上传递的同时,也作用在链上的结构蛋白。随着牵引力增加,结构蛋白构象变得不稳定。当牵引力达到一定阈值,结构蛋白构象被改变。其闭合结构被力打开,暴露出包裹其中的活性位点(图2)。引起力学信号到生化信号的转导。

04
力作用下的转录调控
肌动球蛋白丝束骨架一端通过细胞膜上的粘附蛋白与微环境相连,另一端连通细胞核膜,通过LINC复合体(Linker of nucleoskeleton and cytoskeleton)与细胞核骨架蛋白——核纤层蛋白A/C(Lamin A/C)连接。在肌球蛋白牵引力作用下,核纤层蛋白A/C组装为中间纤维(Intermediate filaments)核骨架。核骨架继续拉动凝聚的染色质,令其舒展(图3)。调控基因表达,改变细胞表现型。

以上细胞感应微环境机械力学特性,并将其转化为转录活性的过程统称为——力学信号转导(Mechanotransduction)。其中,包括机械力在细胞骨架与蛋白分子链的传递,以及转导为生化因子信号激活转录子与转录调节子两条线(图4)。

05
细胞力加载周期动力学变化
蛋白分子链在力加载周期中引起粘附变化,会接连发生滑移键(slip bond)和逆锁键(catch bond)的转变,随着蛋白分子链的构建,一些蛋白分子链超过了机械传导所需的阈值力,导致额外的粘附蛋白聚集,这将增加蛋白分子链的数量,增加力传递能力,但细胞牵引力的过度增长,会造成细胞粘附不稳定,造成粘附蛋白脱离。牵引力达到改变结构蛋白构象、暴露其活性位点的阈值。活性位点的激活,诱导细胞募集与聚集更多粘附蛋白,增强细胞界面粘附作用力(图5)。

总结
与刺激细胞的生化因子一样,机械力学也是调控细胞功能与行为的重要因子。且相比于各异的生化因子,力信号的传递与转导在不同类型细胞中具有普适性。微环境的机械力学性质在调节细胞发育、组织稳态和损伤修复的行为方面发挥重要作用。细胞通过蛋白分子链感应微环境机械力学性质,实现力的传递,并将力学信号转导为基因表达能够识别的生化信号。细胞力学感知与响应的研究为调控细胞行为与功能提供新利器。生物材料的开发与研究,在考虑生物相容性与生化活性的同时,也需要充分考虑材料的机械力学特性。因此,从机理上理解细胞力的传递与转导,将对生物材料的开发起到重要指导作用。
文献链接
https://doi.org/10.1360/TB-2020-1069