当前位置:
X-MOL 学术
›
Acta Pharmacol. Sin.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Oblongifolin C suppresses lysosomal function independently of TFEB nuclear translocation.
Acta Pharmacologica Sinica ( IF 8.2 ) Pub Date : 2018-10-17 , DOI: 10.1038/s41401-018-0167-7 Man Wu 1, 2 , Yuan-Zhi Lao 1, 2 , Hong-Sheng Tan 1, 2 , Guang Lu 3 , Yi Ren 3 , Zhao-Qing Zheng 1, 2 , Juan Yi 3 , Wen-Wei Fu 1, 2 , Han-Ming Shen 3 , Hong-Xi Xu 1, 2
Acta Pharmacologica Sinica ( IF 8.2 ) Pub Date : 2018-10-17 , DOI: 10.1038/s41401-018-0167-7 Man Wu 1, 2 , Yuan-Zhi Lao 1, 2 , Hong-Sheng Tan 1, 2 , Guang Lu 3 , Yi Ren 3 , Zhao-Qing Zheng 1, 2 , Juan Yi 3 , Wen-Wei Fu 1, 2 , Han-Ming Shen 3 , Hong-Xi Xu 1, 2
Affiliation
|
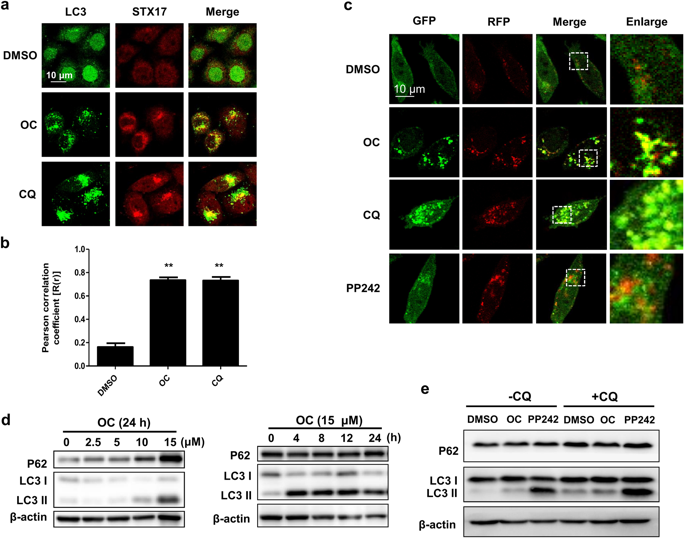
Lysosomes are the terminal organelles of the autophagic-endocytic pathway and play a key role in the degradation of autophagic contents. We previously reported that a natural compound oblongifolin C (OC) increased the number of autophagosomes and impaired the degradation of P62, most likely via suppression of lysosomal function and blockage of autophagosome-lysosome fusion. However, the precise mechanisms of how OC inhibits the lysosome-autophagy pathway remain unclear. In the present study, we investigated the effect of OC on transcription factor EB (TFEB), a master regulator of lysosomal biogenesis, lysosomal function and autophagy. We showed that treatment with OC (15 μM) markedly enhanced the nuclear translocation of TFEB in HeLa cells, concomitantly reduced the interaction of TFEB with 14-3-3 proteins. We further demonstrated that OC caused significant inhibition of mTORC1 along with TFEB nuclear translocation, and OC-mediated TFEB nuclear translocation was dependent on mTORC1 suppression. Intriguingly, this increased nuclear TFEB was accompanied by reduced TFEB luciferase activity, increased lysosomal pH and impaired cathepsin enzyme activities. In HeLa cells, treatment with OC (7.5 μM) resulted in about 30% of cell death, whereas treatment with hydroxycitrate, a caloric restriction mimetic (20 μM) did not affect the cell viability. However, cotreatment with OC and hydroxycitrate caused significantly great cytotoxicity (>50%). Taken together, these results demonstrate that inhibition of lysosome function is mediated by OC, despite evident TFEB nuclear translocation.
中文翻译:

Oblongifolin C 独立于 TFEB 核易位抑制溶酶体功能。
溶酶体是自噬-内吞途径的末端细胞器,在自噬内容物的降解中起关键作用。我们之前报道过一种天然化合物 oblongifolin C (OC) 增加了自噬体的数量并削弱了 P62 的降解,这很可能是通过抑制溶酶体功能和阻断自噬体-溶酶体融合来实现的。然而,OC如何抑制溶酶体-自噬途径的确切机制仍不清楚。在本研究中,我们研究了 OC 对转录因子 EB (TFEB) 的影响,转录因子 EB (TFEB) 是溶酶体生物发生、溶酶体功能和自噬的主要调节因子。我们发现用 OC (15 μM) 处理显着增强了 HeLa 细胞中 TFEB 的核转位,同时降低了 TFEB 与 14-3-3 蛋白的相互作用。我们进一步证明,OC 引起 mTORC1 的显着抑制以及 TFEB 核易位,并且 OC 介导的 TFEB 核易位依赖于 mTORC1 抑制。有趣的是,这种增加的核 TFEB 伴随着 TFEB 荧光素酶活性降低、溶酶体 pH 值升高和组织蛋白酶活性受损。在 HeLa 细胞中,用 OC (7.5 μM) 处理导致约 30% 的细胞死亡,而用羟基柠檬酸盐(一种热量限制模拟物)(20 μM)处理不影响细胞活力。然而,与 OC 和羟基柠檬酸共同处理导致显着的细胞毒性(> 50%)。总之,这些结果表明溶酶体功能的抑制是由 OC 介导的,尽管有明显的 TFEB 核易位。OC 介导的 TFEB 核易位依赖于 mTORC1 抑制。有趣的是,这种增加的核 TFEB 伴随着 TFEB 荧光素酶活性降低、溶酶体 pH 值升高和组织蛋白酶活性受损。在 HeLa 细胞中,用 OC (7.5 μM) 处理导致约 30% 的细胞死亡,而用羟基柠檬酸盐(一种热量限制模拟物)(20 μM)处理不影响细胞活力。然而,与 OC 和羟基柠檬酸共同处理导致显着的细胞毒性(> 50%)。总之,这些结果表明溶酶体功能的抑制是由 OC 介导的,尽管有明显的 TFEB 核易位。OC 介导的 TFEB 核易位依赖于 mTORC1 抑制。有趣的是,这种增加的核 TFEB 伴随着 TFEB 荧光素酶活性降低、溶酶体 pH 值升高和组织蛋白酶活性受损。在 HeLa 细胞中,用 OC (7.5 μM) 处理导致约 30% 的细胞死亡,而用羟基柠檬酸盐(一种热量限制模拟物)(20 μM)处理不影响细胞活力。然而,与 OC 和羟基柠檬酸共同处理导致显着的细胞毒性(> 50%)。总之,这些结果表明溶酶体功能的抑制是由 OC 介导的,尽管有明显的 TFEB 核易位。溶酶体 pH 值升高,组织蛋白酶活性受损。在 HeLa 细胞中,用 OC (7.5 μM) 处理导致约 30% 的细胞死亡,而用羟基柠檬酸盐(一种热量限制模拟物)(20 μM)处理不影响细胞活力。然而,与 OC 和羟基柠檬酸共同处理导致显着的细胞毒性(> 50%)。总之,这些结果表明溶酶体功能的抑制是由 OC 介导的,尽管有明显的 TFEB 核易位。溶酶体 pH 值升高,组织蛋白酶活性受损。在 HeLa 细胞中,用 OC (7.5 μM) 处理导致约 30% 的细胞死亡,而用羟基柠檬酸盐(一种热量限制模拟物)(20 μM)处理不影响细胞活力。然而,与 OC 和羟基柠檬酸共同处理导致显着的细胞毒性(> 50%)。总之,这些结果表明溶酶体功能的抑制是由 OC 介导的,尽管有明显的 TFEB 核易位。
更新日期:2019-01-26
中文翻译:

Oblongifolin C 独立于 TFEB 核易位抑制溶酶体功能。
溶酶体是自噬-内吞途径的末端细胞器,在自噬内容物的降解中起关键作用。我们之前报道过一种天然化合物 oblongifolin C (OC) 增加了自噬体的数量并削弱了 P62 的降解,这很可能是通过抑制溶酶体功能和阻断自噬体-溶酶体融合来实现的。然而,OC如何抑制溶酶体-自噬途径的确切机制仍不清楚。在本研究中,我们研究了 OC 对转录因子 EB (TFEB) 的影响,转录因子 EB (TFEB) 是溶酶体生物发生、溶酶体功能和自噬的主要调节因子。我们发现用 OC (15 μM) 处理显着增强了 HeLa 细胞中 TFEB 的核转位,同时降低了 TFEB 与 14-3-3 蛋白的相互作用。我们进一步证明,OC 引起 mTORC1 的显着抑制以及 TFEB 核易位,并且 OC 介导的 TFEB 核易位依赖于 mTORC1 抑制。有趣的是,这种增加的核 TFEB 伴随着 TFEB 荧光素酶活性降低、溶酶体 pH 值升高和组织蛋白酶活性受损。在 HeLa 细胞中,用 OC (7.5 μM) 处理导致约 30% 的细胞死亡,而用羟基柠檬酸盐(一种热量限制模拟物)(20 μM)处理不影响细胞活力。然而,与 OC 和羟基柠檬酸共同处理导致显着的细胞毒性(> 50%)。总之,这些结果表明溶酶体功能的抑制是由 OC 介导的,尽管有明显的 TFEB 核易位。OC 介导的 TFEB 核易位依赖于 mTORC1 抑制。有趣的是,这种增加的核 TFEB 伴随着 TFEB 荧光素酶活性降低、溶酶体 pH 值升高和组织蛋白酶活性受损。在 HeLa 细胞中,用 OC (7.5 μM) 处理导致约 30% 的细胞死亡,而用羟基柠檬酸盐(一种热量限制模拟物)(20 μM)处理不影响细胞活力。然而,与 OC 和羟基柠檬酸共同处理导致显着的细胞毒性(> 50%)。总之,这些结果表明溶酶体功能的抑制是由 OC 介导的,尽管有明显的 TFEB 核易位。OC 介导的 TFEB 核易位依赖于 mTORC1 抑制。有趣的是,这种增加的核 TFEB 伴随着 TFEB 荧光素酶活性降低、溶酶体 pH 值升高和组织蛋白酶活性受损。在 HeLa 细胞中,用 OC (7.5 μM) 处理导致约 30% 的细胞死亡,而用羟基柠檬酸盐(一种热量限制模拟物)(20 μM)处理不影响细胞活力。然而,与 OC 和羟基柠檬酸共同处理导致显着的细胞毒性(> 50%)。总之,这些结果表明溶酶体功能的抑制是由 OC 介导的,尽管有明显的 TFEB 核易位。溶酶体 pH 值升高,组织蛋白酶活性受损。在 HeLa 细胞中,用 OC (7.5 μM) 处理导致约 30% 的细胞死亡,而用羟基柠檬酸盐(一种热量限制模拟物)(20 μM)处理不影响细胞活力。然而,与 OC 和羟基柠檬酸共同处理导致显着的细胞毒性(> 50%)。总之,这些结果表明溶酶体功能的抑制是由 OC 介导的,尽管有明显的 TFEB 核易位。溶酶体 pH 值升高,组织蛋白酶活性受损。在 HeLa 细胞中,用 OC (7.5 μM) 处理导致约 30% 的细胞死亡,而用羟基柠檬酸盐(一种热量限制模拟物)(20 μM)处理不影响细胞活力。然而,与 OC 和羟基柠檬酸共同处理导致显着的细胞毒性(> 50%)。总之,这些结果表明溶酶体功能的抑制是由 OC 介导的,尽管有明显的 TFEB 核易位。


























 京公网安备 11010802027423号
京公网安备 11010802027423号