当前位置:
X-MOL 学术
›
ACS Earth Space Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Sulfur Redox Cycling Dependent Abiotic Ferrihydrite Reduction by a Desulfitobacterium hafniense
ACS Earth and Space Chemistry ( IF 3.4 ) Pub Date : 2018-03-09 00:00:00 , DOI: 10.1021/acsearthspacechem.8b00012 Guo-Xiang Li 1, 2, 3 , Xue-Ping Chen 4 , Xin-Nan Wang 3, 5 , Zheng Chen 6 , Peng Bao 1, 2
ACS Earth and Space Chemistry ( IF 3.4 ) Pub Date : 2018-03-09 00:00:00 , DOI: 10.1021/acsearthspacechem.8b00012 Guo-Xiang Li 1, 2, 3 , Xue-Ping Chen 4 , Xin-Nan Wang 3, 5 , Zheng Chen 6 , Peng Bao 1, 2
Affiliation
|
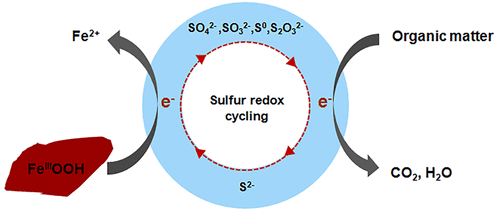
Biogeochemical interactions of iron and sulfur drive their cycles in many environments, which makes understanding the mechanism of sulfur redox cycling dependent abiotic iron(III) reduction by sulfate-reducing bacteria (SRB) particularly important. Here, we present a newly isolated Desulfitobacterium hafniense strain DH with the potential of reducing sulfate, sulfite, thiosulfate, and elemental sulfur from a paddy soil. Strain DH cannot enzymatically reduce ferrihydrite, but it can abiotically reduce ferrihydrite through extracellular electron transfer with biogenic sulfide or other sulfur compounds acting as electron shuttles. Sulfite, elemental sulfur, and thiosulfate, the oxidation products of sulfide, complete the sulfur cycle between ferrihydrite and strain DH. The presence of strain DH at the ferrihydrite surface results in mineral dissolution and secondary mineralization. Proteomic analysis revealed that the expression level of sulfur reduction functional protein DsrC and a thiosulfate reductase in the sulfide/ferrihydrite amendment group was 1.79 and 1.99 times higher, respectively, than in the sulfide-only amendment setup. On the other hand, the protein expression level of DsrAB showed no significant variation. A number of carbon metabolism enzymes, including succinate dehydrogenase (2.46 fold), fumarate reductase (2.64 fold), acetyl-coenzyme A synthetase (2.64 fold) and phosphoenolpyruvate synthase (3.4 fold), were up-regulated significantly due to the stimulation of released ferrous ion that was generated during the sulfur redox cycling dependent abiotic ferrihydrite reduction process. This result confirms the important role of DsrC and thiosulfate reductase in sulfur redox cycling dependent abiotic ferrihydrite reduction. Sulfur redox cycling dependent abiotic iron oxide reduction mediated by SRB might be a widespread process in the environment.
中文翻译:

Hafniense脱硫细菌还原依赖硫氧化还原循环的非生物亚铁水合物
铁和硫的生物地球化学相互作用在许多环境中驱动其循环,这使得了解硫酸还原还原循环(SRB)对硫氧化还原循环依赖性非生物铁(III)还原的机理尤为重要。在这里,我们介绍了一种新分离的哈夫氏脱硫杆菌菌株DH具有还原稻田土壤中硫酸盐,亚硫酸盐,硫代硫酸盐和元素硫的潜力。菌株DH不能酶促还原亚铁酸盐,但它可以通过与生物硫化物或其他充当电子穿梭物的硫化合物的细胞外电子转移,非生物还原亚铁酸盐。亚硫酸盐,元素硫和硫代硫酸盐(硫化物的氧化产物)完成了亚铁酸盐和DH菌株之间的硫循环。在亚铁水合物表面存在DH菌株会导致矿物溶解和二次矿化。蛋白质组学分析表明,与仅使用硫化物的修饰物设置相比,在硫化物/水铁矿修饰物组中,硫还原功能蛋白DsrC和硫代硫酸盐还原酶的表达水平分别高1.79倍和1.99倍。另一方面,DsrAB蛋白表达水平无明显变化。由于刺激了释放的刺激,包括丁二酸脱氢酶(2.46倍),富马酸酯还原酶(2.64倍),乙酰辅酶A合成酶(2.64倍)和磷酸烯醇丙酮酸合酶(3.4倍)在内的许多碳代谢酶均被上调。依赖于硫氧化还原循环的非生物亚铁水合物还原过程中生成的亚铁离子。该结果证实了DsrC和硫代硫酸盐还原酶在依赖硫氧化还原循环的非生物亚铁水合物还原中的重要作用。由SRB介导的依赖硫氧化还原循环的非生物氧化铁还原可能是环境中的一个广泛过程。包括琥珀酸脱氢酶(2.46倍),富马酸还原酶(2.64倍),乙酰辅酶A合成酶(2.64倍)和磷酸烯醇丙酮酸合酶(3.4倍),由于刺激过程中产生的释放的亚铁离子的刺激而显着上调。硫氧化还原循环依赖非生物亚铁水合物的还原过程。该结果证实了DsrC和硫代硫酸盐还原酶在依赖硫氧化还原循环的非生物亚铁水合物还原中的重要作用。由SRB介导的依赖硫氧化还原循环的非生物氧化铁还原可能是环境中的一个广泛过程。包括琥珀酸脱氢酶(2.46倍),富马酸还原酶(2.64倍),乙酰辅酶A合成酶(2.64倍)和磷酸烯醇丙酮酸合酶(3.4倍),由于刺激过程中产生的释放的亚铁离子的刺激而显着上调。硫氧化还原循环依赖非生物亚铁水合物的还原过程。该结果证实了DsrC和硫代硫酸盐还原酶在依赖硫氧化还原循环的非生物亚铁水合物还原中的重要作用。由SRB介导的依赖硫氧化还原循环的非生物氧化铁还原可能是环境中的一个广泛过程。由于刺激了依赖于硫氧化还原循环的非生物亚铁水铁矿还原过程中产生的释放的亚铁离子,因此它们显着上调。该结果证实了DsrC和硫代硫酸盐还原酶在依赖硫氧化还原循环的非生物亚铁水合物还原中的重要作用。由SRB介导的依赖硫氧化还原循环的非生物氧化铁还原可能是环境中的一个广泛过程。由于刺激了依赖于硫氧化还原循环的非生物亚铁水铁矿还原过程中产生的释放的亚铁离子,因此它们显着上调。该结果证实了DsrC和硫代硫酸盐还原酶在依赖硫氧化还原循环的非生物亚铁水合物还原中的重要作用。由SRB介导的依赖硫氧化还原循环的非生物氧化铁还原可能是环境中的一个广泛过程。
更新日期:2018-03-09
中文翻译:

Hafniense脱硫细菌还原依赖硫氧化还原循环的非生物亚铁水合物
铁和硫的生物地球化学相互作用在许多环境中驱动其循环,这使得了解硫酸还原还原循环(SRB)对硫氧化还原循环依赖性非生物铁(III)还原的机理尤为重要。在这里,我们介绍了一种新分离的哈夫氏脱硫杆菌菌株DH具有还原稻田土壤中硫酸盐,亚硫酸盐,硫代硫酸盐和元素硫的潜力。菌株DH不能酶促还原亚铁酸盐,但它可以通过与生物硫化物或其他充当电子穿梭物的硫化合物的细胞外电子转移,非生物还原亚铁酸盐。亚硫酸盐,元素硫和硫代硫酸盐(硫化物的氧化产物)完成了亚铁酸盐和DH菌株之间的硫循环。在亚铁水合物表面存在DH菌株会导致矿物溶解和二次矿化。蛋白质组学分析表明,与仅使用硫化物的修饰物设置相比,在硫化物/水铁矿修饰物组中,硫还原功能蛋白DsrC和硫代硫酸盐还原酶的表达水平分别高1.79倍和1.99倍。另一方面,DsrAB蛋白表达水平无明显变化。由于刺激了释放的刺激,包括丁二酸脱氢酶(2.46倍),富马酸酯还原酶(2.64倍),乙酰辅酶A合成酶(2.64倍)和磷酸烯醇丙酮酸合酶(3.4倍)在内的许多碳代谢酶均被上调。依赖于硫氧化还原循环的非生物亚铁水合物还原过程中生成的亚铁离子。该结果证实了DsrC和硫代硫酸盐还原酶在依赖硫氧化还原循环的非生物亚铁水合物还原中的重要作用。由SRB介导的依赖硫氧化还原循环的非生物氧化铁还原可能是环境中的一个广泛过程。包括琥珀酸脱氢酶(2.46倍),富马酸还原酶(2.64倍),乙酰辅酶A合成酶(2.64倍)和磷酸烯醇丙酮酸合酶(3.4倍),由于刺激过程中产生的释放的亚铁离子的刺激而显着上调。硫氧化还原循环依赖非生物亚铁水合物的还原过程。该结果证实了DsrC和硫代硫酸盐还原酶在依赖硫氧化还原循环的非生物亚铁水合物还原中的重要作用。由SRB介导的依赖硫氧化还原循环的非生物氧化铁还原可能是环境中的一个广泛过程。包括琥珀酸脱氢酶(2.46倍),富马酸还原酶(2.64倍),乙酰辅酶A合成酶(2.64倍)和磷酸烯醇丙酮酸合酶(3.4倍),由于刺激过程中产生的释放的亚铁离子的刺激而显着上调。硫氧化还原循环依赖非生物亚铁水合物的还原过程。该结果证实了DsrC和硫代硫酸盐还原酶在依赖硫氧化还原循环的非生物亚铁水合物还原中的重要作用。由SRB介导的依赖硫氧化还原循环的非生物氧化铁还原可能是环境中的一个广泛过程。由于刺激了依赖于硫氧化还原循环的非生物亚铁水铁矿还原过程中产生的释放的亚铁离子,因此它们显着上调。该结果证实了DsrC和硫代硫酸盐还原酶在依赖硫氧化还原循环的非生物亚铁水合物还原中的重要作用。由SRB介导的依赖硫氧化还原循环的非生物氧化铁还原可能是环境中的一个广泛过程。由于刺激了依赖于硫氧化还原循环的非生物亚铁水铁矿还原过程中产生的释放的亚铁离子,因此它们显着上调。该结果证实了DsrC和硫代硫酸盐还原酶在依赖硫氧化还原循环的非生物亚铁水合物还原中的重要作用。由SRB介导的依赖硫氧化还原循环的非生物氧化铁还原可能是环境中的一个广泛过程。



























 京公网安备 11010802027423号
京公网安备 11010802027423号