当前位置:
X-MOL 学术
›
J. Phys. Chem. B
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Ethanol Controls the Self-Assembly and Mesoscopic Properties of Human Insulin Amyloid Spherulites
The Journal of Physical Chemistry B ( IF 3.3 ) Pub Date : 2018-02-28 00:00:00 , DOI: 10.1021/acs.jpcb.8b01779 Valeria Vetri 1 , Federica Piccirilli 1 , Johannes Krausser 2 , Gianpiero Buscarino 1 , Urszula Łapińska 3 , Bente Vestergaard , Alessio Zaccone 2 , Vito Foderà
The Journal of Physical Chemistry B ( IF 3.3 ) Pub Date : 2018-02-28 00:00:00 , DOI: 10.1021/acs.jpcb.8b01779 Valeria Vetri 1 , Federica Piccirilli 1 , Johannes Krausser 2 , Gianpiero Buscarino 1 , Urszula Łapińska 3 , Bente Vestergaard , Alessio Zaccone 2 , Vito Foderà
Affiliation
|
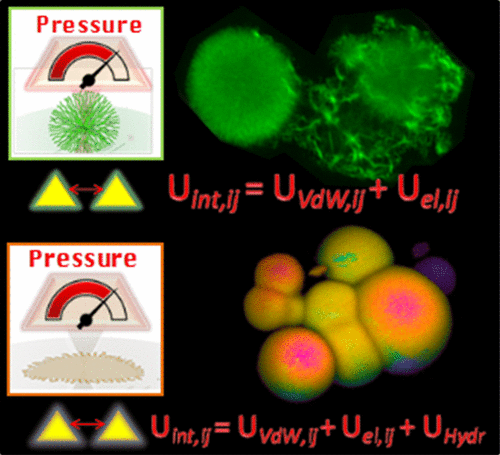
Protein self-assembly into amyloid fibrils or highly hierarchical superstructures is closely linked to neurodegenerative pathologies as Alzheimer’s and Parkinson’s diseases. Moreover, protein assemblies also emerged as building blocks for bioinspired nanostructured materials. In both the above mentioned fields, the main challenge is to control the growth and properties of the final protein structure. This relies on a more fundamental understanding of how interactions between proteins can determine structures and functions of biomolecular aggregates. Here, we identify a striking effect of the hydration of the single human insulin molecule and solvent properties in controlling hydrophobicity/hydrophilicity, structures, and morphologies of a superstructure named spherulite, observed in connection to Alzheimer’s disease. Depending on the presence of ethanol, such structures can incorporate fluorescent molecules with different physicochemical features and span a range of mechanical properties and morphologies. A theoretical model providing a thorough comprehension of the experimental data is developed, highlighting a direct connection between the intimate physical protein–protein interactions, the growth, and the properties of the self-assembled superstructures. Our findings indicate structural variability as a general property for amyloid-like aggregates and not limited to fibrils. This knowledge is pivotal not only for developing effective strategies against pathological amyloids but also for providing a platform to design highly tunable biomaterials, alternative to elongated protein fibrils.
中文翻译:

乙醇控制人胰岛素淀粉样球蛋白的自组装和介观性质
蛋白质自组装成淀粉样蛋白原纤维或高度分层的超结构与神经退行性疾病如阿尔茨海默氏病和帕金森氏病密切相关。此外,蛋白质组装也已成为生物启发性纳米结构材料的基础。在上述两个领域中,主要挑战是控制最终蛋白质结构的生长和特性。这依赖于对蛋白质之间的相互作用如何确定生物分子聚集体的结构和功能的更基本的理解。在这里,我们确定了单个人胰岛素分子的水合作用和溶剂特性在控制与阿尔茨海默氏病有关的疏水性/亲水性,上层结构(称为球晶)的形态和形态方面的惊人作用。取决于乙醇的存在,这样的结构可以结合具有不同物理化学特征的荧光分子,并跨越一系列的机械性质和形态。建立了一个理论模型,提供了对实验数据的全面理解,强调了紧密的物理蛋白质-蛋白质相互作用,生长和自组装上部结构的性质之间的直接联系。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。这样的结构可以结合具有不同物理化学特征的荧光分子,并跨越一系列的机械性质和形态。建立了一个理论模型,提供了对实验数据的全面理解,强调了紧密的物理蛋白质-蛋白质相互作用,生长和自组装上部结构的性质之间的直接联系。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。这样的结构可以结合具有不同物理化学特征的荧光分子,并跨越一系列的机械性质和形态。建立了一个理论模型,提供了对实验数据的全面理解,强调了紧密的物理蛋白质-蛋白质相互作用,生长和自组装上部结构的性质之间的直接联系。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。建立了一个理论模型,提供了对实验数据的全面理解,强调了紧密的物理蛋白质-蛋白质相互作用,生长和自组装上部结构的性质之间的直接联系。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。建立了一个理论模型,提供了对实验数据的全面理解,强调了紧密的物理蛋白质-蛋白质相互作用,生长和自组装上部结构的性质之间的直接联系。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。
更新日期:2018-02-28
中文翻译:

乙醇控制人胰岛素淀粉样球蛋白的自组装和介观性质
蛋白质自组装成淀粉样蛋白原纤维或高度分层的超结构与神经退行性疾病如阿尔茨海默氏病和帕金森氏病密切相关。此外,蛋白质组装也已成为生物启发性纳米结构材料的基础。在上述两个领域中,主要挑战是控制最终蛋白质结构的生长和特性。这依赖于对蛋白质之间的相互作用如何确定生物分子聚集体的结构和功能的更基本的理解。在这里,我们确定了单个人胰岛素分子的水合作用和溶剂特性在控制与阿尔茨海默氏病有关的疏水性/亲水性,上层结构(称为球晶)的形态和形态方面的惊人作用。取决于乙醇的存在,这样的结构可以结合具有不同物理化学特征的荧光分子,并跨越一系列的机械性质和形态。建立了一个理论模型,提供了对实验数据的全面理解,强调了紧密的物理蛋白质-蛋白质相互作用,生长和自组装上部结构的性质之间的直接联系。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。这样的结构可以结合具有不同物理化学特征的荧光分子,并跨越一系列的机械性质和形态。建立了一个理论模型,提供了对实验数据的全面理解,强调了紧密的物理蛋白质-蛋白质相互作用,生长和自组装上部结构的性质之间的直接联系。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。这样的结构可以结合具有不同物理化学特征的荧光分子,并跨越一系列的机械性质和形态。建立了一个理论模型,提供了对实验数据的全面理解,强调了紧密的物理蛋白质-蛋白质相互作用,生长和自组装上部结构的性质之间的直接联系。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。建立了一个理论模型,提供了对实验数据的全面理解,强调了紧密的物理蛋白质-蛋白质相互作用,生长和自组装上部结构的性质之间的直接联系。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。建立了一个理论模型,提供了对实验数据的全面理解,强调了紧密的物理蛋白质-蛋白质相互作用,生长和自组装上部结构的性质之间的直接联系。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。我们的发现表明结构可变性是淀粉样蛋白聚集体的一般性质,而不仅限于原纤维。该知识不仅对于开发针对病理性淀粉样蛋白的有效策略至关重要,而且对于提供设计高度可调的生物材料(替代拉长的蛋白原纤维)的平台也至关重要。



























 京公网安备 11010802027423号
京公网安备 11010802027423号