Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
The cryo-electron microscopy structure of huntingtin
Nature ( IF 64.8 ) Pub Date : 2018-02-21 , DOI: 10.1038/nature25502 Qiang Guo 1 , Bin Huang 2 , Jingdong Cheng 3 , Manuel Seefelder 2 , Tatjana Engler 2 , Günter Pfeifer 1 , Patrick Oeckl 4 , Markus Otto 4 , Franziska Moser 5 , Melanie Maurer 5 , Alexander Pautsch 5 , Wolfgang Baumeister 1 , Rubén Fernández-Busnadiego 1 , Stefan Kochanek 2
Nature ( IF 64.8 ) Pub Date : 2018-02-21 , DOI: 10.1038/nature25502 Qiang Guo 1 , Bin Huang 2 , Jingdong Cheng 3 , Manuel Seefelder 2 , Tatjana Engler 2 , Günter Pfeifer 1 , Patrick Oeckl 4 , Markus Otto 4 , Franziska Moser 5 , Melanie Maurer 5 , Alexander Pautsch 5 , Wolfgang Baumeister 1 , Rubén Fernández-Busnadiego 1 , Stefan Kochanek 2
Affiliation
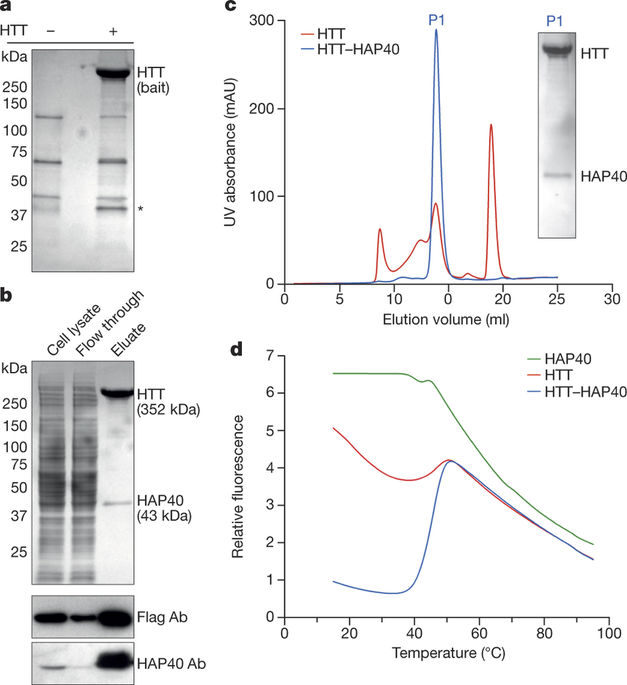
|
Huntingtin (HTT) is a large (348 kDa) protein that is essential for embryonic development and is involved in diverse cellular activities such as vesicular transport, endocytosis, autophagy and the regulation of transcription. Although an integrative understanding of the biological functions of HTT is lacking, the large number of identified HTT interactors suggests that it serves as a protein–protein interaction hub. Furthermore, Huntington’s disease is caused by a mutation in the HTT gene, resulting in a pathogenic expansion of a polyglutamine repeat at the amino terminus of HTT. However, only limited structural information regarding HTT is currently available. Here we use cryo-electron microscopy to determine the structure of full-length human HTT in a complex with HTT-associated protein 40 (HAP40; encoded by three F8A genes in humans) to an overall resolution of 4 Å. HTT is largely α-helical and consists of three major domains. The amino- and carboxy-terminal domains contain multiple HEAT (huntingtin, elongation factor 3, protein phosphatase 2A and lipid kinase TOR) repeats arranged in a solenoid fashion. These domains are connected by a smaller bridge domain containing different types of tandem repeats. HAP40 is also largely α-helical and has a tetratricopeptide repeat-like organization. HAP40 binds in a cleft and contacts the three HTT domains by hydrophobic and electrostatic interactions, thereby stabilizing the conformation of HTT. These data rationalize previous biochemical results and pave the way for improved understanding of the diverse cellular functions of HTT.
中文翻译:

亨廷顿蛋白的低温电子显微镜结构
Huntingtin (HTT) 是一种大型 (348 kDa) 蛋白质,对胚胎发育至关重要,并参与多种细胞活动,如囊泡运输、内吞作用、自噬和转录调控。尽管缺乏对 HTT 生物学功能的综合理解,但大量已鉴定的 HTT 相互作用物表明它是蛋白质-蛋白质相互作用的枢纽。此外,亨廷顿氏病是由 HTT 基因突变引起的,导致 HTT 氨基末端的多聚谷氨酰胺重复序列的致病性扩增。然而,目前只有有限的关于 HTT 的结构信息可用。在这里,我们使用低温电子显微镜来确定全长人类 HTT 在与 HTT 相关蛋白 40 (HAP40; 由人类的三个 F8A 基因编码),总分辨率为 4 Å。HTT 主要是 α-螺旋结构,由三个主要结构域组成。氨基末端和羧基末端结构域包含多个以螺线管方式排列的 HEAT(亨廷顿蛋白、延伸因子 3、蛋白磷酸酶 2A 和脂质激酶 TOR)重复。这些结构域由包含不同类型串联重复序列的较小桥结构域连接。HAP40 也主要是 α-螺旋并具有四肽重复样结构。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。HTT 主要是 α-螺旋结构,由三个主要结构域组成。氨基末端和羧基末端结构域包含多个以螺线管方式排列的 HEAT(亨廷顿蛋白、延伸因子 3、蛋白磷酸酶 2A 和脂质激酶 TOR)重复。这些结构域由包含不同类型串联重复序列的较小桥结构域连接。HAP40 也主要是 α-螺旋并具有四肽重复样结构。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。HTT 主要是 α-螺旋结构,由三个主要结构域组成。氨基末端和羧基末端结构域包含多个以螺线管方式排列的 HEAT(亨廷顿蛋白、延伸因子 3、蛋白磷酸酶 2A 和脂质激酶 TOR)重复。这些结构域由包含不同类型串联重复序列的较小桥结构域连接。HAP40 也主要是 α-螺旋并具有四肽重复样结构。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。蛋白磷酸酶 2A 和脂质激酶 TOR) 重复以螺线管方式排列。这些结构域由包含不同类型串联重复序列的较小桥结构域连接。HAP40 也主要是 α-螺旋并具有四肽重复样结构。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。蛋白磷酸酶 2A 和脂质激酶 TOR) 重复以螺线管方式排列。这些结构域由包含不同类型串联重复序列的较小桥结构域连接。HAP40 也主要是 α-螺旋并具有四肽重复样结构。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。
更新日期:2018-02-21
中文翻译:

亨廷顿蛋白的低温电子显微镜结构
Huntingtin (HTT) 是一种大型 (348 kDa) 蛋白质,对胚胎发育至关重要,并参与多种细胞活动,如囊泡运输、内吞作用、自噬和转录调控。尽管缺乏对 HTT 生物学功能的综合理解,但大量已鉴定的 HTT 相互作用物表明它是蛋白质-蛋白质相互作用的枢纽。此外,亨廷顿氏病是由 HTT 基因突变引起的,导致 HTT 氨基末端的多聚谷氨酰胺重复序列的致病性扩增。然而,目前只有有限的关于 HTT 的结构信息可用。在这里,我们使用低温电子显微镜来确定全长人类 HTT 在与 HTT 相关蛋白 40 (HAP40; 由人类的三个 F8A 基因编码),总分辨率为 4 Å。HTT 主要是 α-螺旋结构,由三个主要结构域组成。氨基末端和羧基末端结构域包含多个以螺线管方式排列的 HEAT(亨廷顿蛋白、延伸因子 3、蛋白磷酸酶 2A 和脂质激酶 TOR)重复。这些结构域由包含不同类型串联重复序列的较小桥结构域连接。HAP40 也主要是 α-螺旋并具有四肽重复样结构。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。HTT 主要是 α-螺旋结构,由三个主要结构域组成。氨基末端和羧基末端结构域包含多个以螺线管方式排列的 HEAT(亨廷顿蛋白、延伸因子 3、蛋白磷酸酶 2A 和脂质激酶 TOR)重复。这些结构域由包含不同类型串联重复序列的较小桥结构域连接。HAP40 也主要是 α-螺旋并具有四肽重复样结构。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。HTT 主要是 α-螺旋结构,由三个主要结构域组成。氨基末端和羧基末端结构域包含多个以螺线管方式排列的 HEAT(亨廷顿蛋白、延伸因子 3、蛋白磷酸酶 2A 和脂质激酶 TOR)重复。这些结构域由包含不同类型串联重复序列的较小桥结构域连接。HAP40 也主要是 α-螺旋并具有四肽重复样结构。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。蛋白磷酸酶 2A 和脂质激酶 TOR) 重复以螺线管方式排列。这些结构域由包含不同类型串联重复序列的较小桥结构域连接。HAP40 也主要是 α-螺旋并具有四肽重复样结构。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。蛋白磷酸酶 2A 和脂质激酶 TOR) 重复以螺线管方式排列。这些结构域由包含不同类型串联重复序列的较小桥结构域连接。HAP40 也主要是 α-螺旋并具有四肽重复样结构。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。HAP40 在裂缝中结合并通过疏水和静电相互作用接触三个 HTT 结构域,从而稳定 HTT 的构象。这些数据合理化了之前的生化结果,并为更好地理解 HTT 的多种细胞功能铺平了道路。



























 京公网安备 11010802027423号
京公网安备 11010802027423号