当前位置:
X-MOL 学术
›
ACS Chem. Neurosci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Neurodegenerative Disease Proteinopathies Are Connected to Distinct Histone Post-translational Modification Landscapes
ACS Chemical Neuroscience ( IF 5 ) Pub Date : 2017-12-15 00:00:00 , DOI: 10.1021/acschemneuro.7b00297 Karen Chen 1 , Seth A. Bennett 1, 2 , Navin Rana 1 , Huda Yousuf 1 , Mohamed Said 1 , Sadiqa Taaseen 1 , Natalie Mendo 1 , Steven M. Meltser 1 , Mariana P. Torrente 1, 3
ACS Chemical Neuroscience ( IF 5 ) Pub Date : 2017-12-15 00:00:00 , DOI: 10.1021/acschemneuro.7b00297 Karen Chen 1 , Seth A. Bennett 1, 2 , Navin Rana 1 , Huda Yousuf 1 , Mohamed Said 1 , Sadiqa Taaseen 1 , Natalie Mendo 1 , Steven M. Meltser 1 , Mariana P. Torrente 1, 3
Affiliation
|
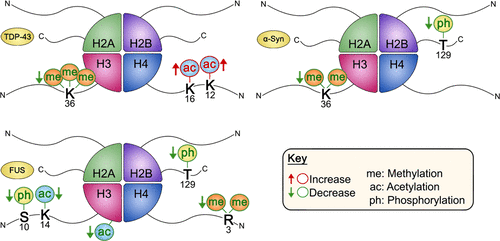
Amyotrophic lateral sclerosis (ALS) and Parkinson’s disease (PD) are devastating neurodegenerative diseases involving the progressive degeneration of neurons. No cure is available for patients diagnosed with these diseases. A prominent feature of both ALS and PD is the accumulation of protein inclusions in the cytoplasm of degenerating neurons; however, the particular proteins constituting these inclusions vary: the RNA-binding proteins TDP-43 and FUS are most notable in ALS, while α-synuclein aggregates into Lewy bodies in PD. In both diseases, genetic causes fail to explain the occurrence of a large proportion of cases, and thus, both are considered mostly sporadic. Despite mounting evidence for a possible role of epigenetics in the occurrence and progression of ALS and PD, epigenetic mechanisms in the context of these diseases remain mostly unexplored. Here we comprehensively delineate histone post-translational modification (PTM) profiles in ALS and PD yeast proteinopathy models. Remarkably, we find distinct changes in histone modification profiles for each. We detect the most striking changes in the context of FUS aggregation: changes in several histone marks support a global decrease in gene transcription. We also detect more modest changes in histone modifications in cells overexpressing TDP-43 or α-synuclein. Our results highlight a great need for the inclusion of epigenetic mechanisms in the study of neurodegeneration. We hope our work will pave the way for the discovery of more effective therapies to treat patients suffering from ALS, PD, and other neurodegenerative diseases.
中文翻译:

神经退行性疾病蛋白病被连接到不同的组蛋白翻译后修饰景观。
肌萎缩性侧索硬化症(ALS)和帕金森氏病(PD)是破坏性的神经退行性疾病,涉及神经元的进行性退化。被诊断患有这些疾病的患者无法治愈。ALS和PD的一个显着特征是退化神经元细胞质中蛋白质包裹体的积累。然而,构成这些内含物的特定蛋白质却有所不同:RNA结合蛋白TDP-43和FUS在ALS中最显着,而α-突触核蛋白则聚集在PD的路易体中。在这两种疾病中,遗传原因均不能解释大部分病例的发生,因此,这两种疾病大多被认为是零星的。尽管有越来越多的证据表明表观遗传学可能在ALS和PD的发生和发展中发挥作用,在这些疾病的背景下,表观遗传机制仍未开发。在这里,我们全面描述了ALS和PD酵母蛋白病模型中的组蛋白翻译后修饰(PTM)配置文件。值得注意的是,我们发现每种蛋白在组蛋白修饰谱中都有明显的变化。我们检测到FUS聚合中最显着的变化:几个组蛋白标记的变化支持基因转录的全球减少。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。在这里,我们全面描述了ALS和PD酵母蛋白病模型中的组蛋白翻译后修饰(PTM)配置文件。值得注意的是,我们发现每种蛋白在组蛋白修饰谱中都有明显的变化。我们在FUS聚合的背景下检测到最引人注目的变化:几个组蛋白标记的变化支持基因转录的全球减少。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。在这里,我们全面描述了ALS和PD酵母蛋白病模型中的组蛋白翻译后修饰(PTM)配置文件。值得注意的是,我们发现每种蛋白在组蛋白修饰谱中都有明显的变化。我们检测到FUS聚合中最显着的变化:几个组蛋白标记的变化支持基因转录的全球减少。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。值得注意的是,我们发现每种蛋白在组蛋白修饰谱中都有明显的变化。我们检测到FUS聚合中最显着的变化:几个组蛋白标记的变化支持基因转录的全球减少。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。值得注意的是,我们发现每种蛋白在组蛋白修饰谱中都有明显的变化。我们检测到FUS聚合中最显着的变化:几个组蛋白标记的变化支持基因转录的全球减少。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果凸显了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。
更新日期:2017-12-15
中文翻译:

神经退行性疾病蛋白病被连接到不同的组蛋白翻译后修饰景观。
肌萎缩性侧索硬化症(ALS)和帕金森氏病(PD)是破坏性的神经退行性疾病,涉及神经元的进行性退化。被诊断患有这些疾病的患者无法治愈。ALS和PD的一个显着特征是退化神经元细胞质中蛋白质包裹体的积累。然而,构成这些内含物的特定蛋白质却有所不同:RNA结合蛋白TDP-43和FUS在ALS中最显着,而α-突触核蛋白则聚集在PD的路易体中。在这两种疾病中,遗传原因均不能解释大部分病例的发生,因此,这两种疾病大多被认为是零星的。尽管有越来越多的证据表明表观遗传学可能在ALS和PD的发生和发展中发挥作用,在这些疾病的背景下,表观遗传机制仍未开发。在这里,我们全面描述了ALS和PD酵母蛋白病模型中的组蛋白翻译后修饰(PTM)配置文件。值得注意的是,我们发现每种蛋白在组蛋白修饰谱中都有明显的变化。我们检测到FUS聚合中最显着的变化:几个组蛋白标记的变化支持基因转录的全球减少。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。在这里,我们全面描述了ALS和PD酵母蛋白病模型中的组蛋白翻译后修饰(PTM)配置文件。值得注意的是,我们发现每种蛋白在组蛋白修饰谱中都有明显的变化。我们在FUS聚合的背景下检测到最引人注目的变化:几个组蛋白标记的变化支持基因转录的全球减少。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。在这里,我们全面描述了ALS和PD酵母蛋白病模型中的组蛋白翻译后修饰(PTM)配置文件。值得注意的是,我们发现每种蛋白在组蛋白修饰谱中都有明显的变化。我们检测到FUS聚合中最显着的变化:几个组蛋白标记的变化支持基因转录的全球减少。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。值得注意的是,我们发现每种蛋白在组蛋白修饰谱中都有明显的变化。我们检测到FUS聚合中最显着的变化:几个组蛋白标记的变化支持基因转录的全球减少。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。值得注意的是,我们发现每种蛋白在组蛋白修饰谱中都有明显的变化。我们检测到FUS聚合中最显着的变化:几个组蛋白标记的变化支持基因转录的全球减少。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果强调了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。我们还检测到过表达TDP-43或α-突触核蛋白的细胞中组蛋白修饰的适度变化。我们的结果凸显了在神经退行性疾病研究中纳入表观遗传机制的巨大需求。我们希望我们的工作将为发现更有效的疗法来治疗患有ALS,PD和其他神经退行性疾病的患者铺平道路。


























 京公网安备 11010802027423号
京公网安备 11010802027423号