天然产物Avenaol的全合成
包含复杂三维结构的天然产物在合成时十分具有挑战性,因而受到许多研究团队的密切关注。笼状的天然产物常常表现出特殊的生物活性,促使人们开发新颖的策略实现其快速高效的合成。此外,那些非笼状的天然产物通过适当的转化形成笼状化合物后也可以表现出广谱的生物活性。天然产物Avenaol、Shagene A、Erythrolide A以及Arisanlactone C等都具有全顺式取代的环丙烷并环结构,尽管这类分子不具有笼状结构,但在合成时具有很大的难度,目前尚无该类分子合成的报道。Avenaol是日本宇都宫大学的Koichi Yoneyama等人于2014年首次从一种燕麦(Avena strigosa)中分离得到的独脚金内酯类天然产物,NMR和高分辨质谱分析表明该分子中具有双环的[4.1.0]庚酮骨架、一个C环内酯环、四个连续的立体中心和全顺式取代的环丙烷结构。该天然产物具有对Phelipanche ramosa 类植物种子潜在的催生发芽活性。
最近,日本京都大学的Chihiro Tsukano博士等人报道了Avenaol的全合成工作。他们以亚烃基环丙烷作为中间体构建全顺式取代的环丙烷,并通过Rh催化的分子内联烯的环丙烷化、Ir催化的双键立体选择性异构化等关键步骤实现分子重要结构的设计。该工作有效避免了合成过程中发生环丙烷开环及笼状结构的形成。相关工作发表在Nature Communications 上。
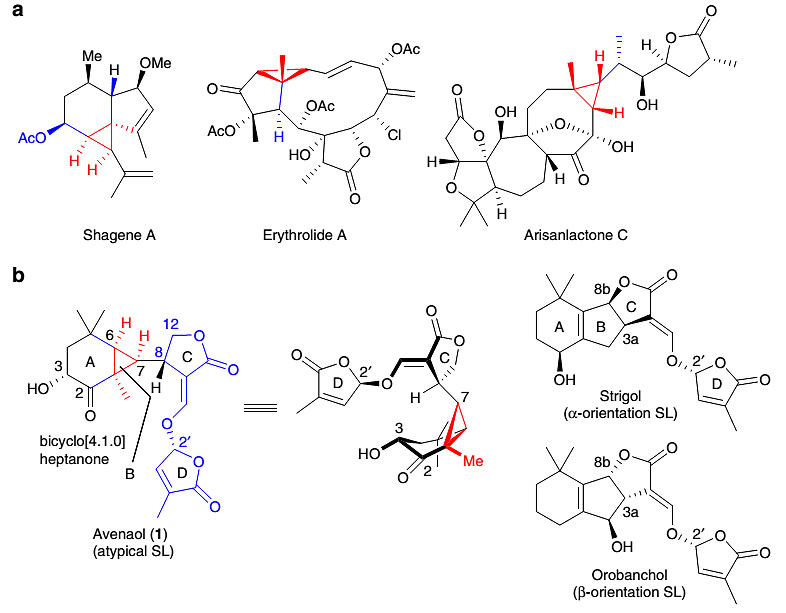
图1. 具有全顺式取代环丙烷结构的天然产物。图片来源:Nat. Commun.
作者首先对Avenaol进行了逆合成分析研究,作者分析Avenaol可以通过中间体2的双羟基化反应并引入D环实现。C环内酯可以通过中间体3中二醇的非对映选择性转化实现,中间体3可以通过全顺式环丙烷中间体4引入羟甲基来合成。中间体4可以首先通过亚烃基环丙烷中间体5发生双键异构化,而5可以通过联烯中间体6的分子内环丙烷化反应来实现,而6可以从相应的醛7出发进行合成。
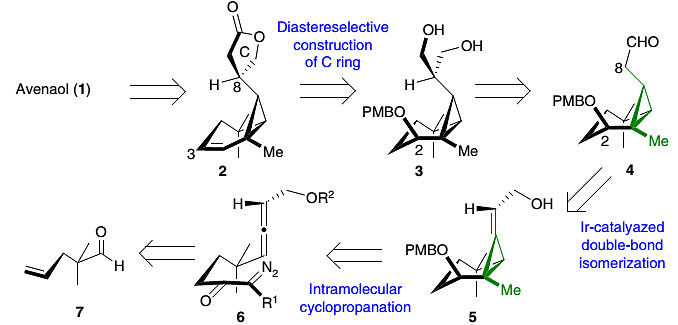
图2. 逆合成分析。图片来源:Nat. Commun.
作者先合成了顺式全取代环丙烷中间体4。醛7与THP保护的炔丙醇在BnMe3NOH的作用下发生加成反应,接着进行甲基化和酸解消除THP保护基高收率地得到中间体8。中间体8随后进行铝氢化反应,产生的中间体在碘的作用下得到9,9接着依序进行羟基TIPS保护基修饰、硼氢化和氧化三步反应得到羧酸衍生物10a。10a接着通过制备相应的β-羰基腈中间体,再进行重氮转化得到环丙烷化反应的前体α-重氮-β-羰基腈中间体6a。9也可以进行相应的羟基苄基保护基修饰,后续反应过程相似。
作者对中间体6的环丙烷化反应进行了条件的探索,详细条件可参考图4,R1 为氰基、R2为TIPS或苄基保护基时,反应使用Rh2(OAc)4作为催化剂能以优秀的产率得到环化中间体11(图4)。中间体11随后进行还原和羟基保护两步反应得到中间体12,两步产率分别为95%和97%。中间体12首先通过DIBAL-H和NaBH4两次还原为醇以两步76%的总收率得到中间体13。作者随后集中研究顺式全取代环丙烷的构建,首先尝试中间体12在Pd/C催化剂的作用下进行氢化还原,然而仅得到以反式构型为主的产物,这一结果可能是由于氰基的位阻效应引起的。作者随后将目光转移到烯烃的异构化策略,为了选择最优的导向基团,通过对氰基的逐步还原制备相应的醇13、甲基化中间体14和烯丙醇5,并在Ir催化剂作用下对烯烃异构化反应的条件进行筛选,最终确定最佳的条件是R1为甲基,R2为氢,以68%的产率和10/1的非对映选择性得到全顺式的产物4。
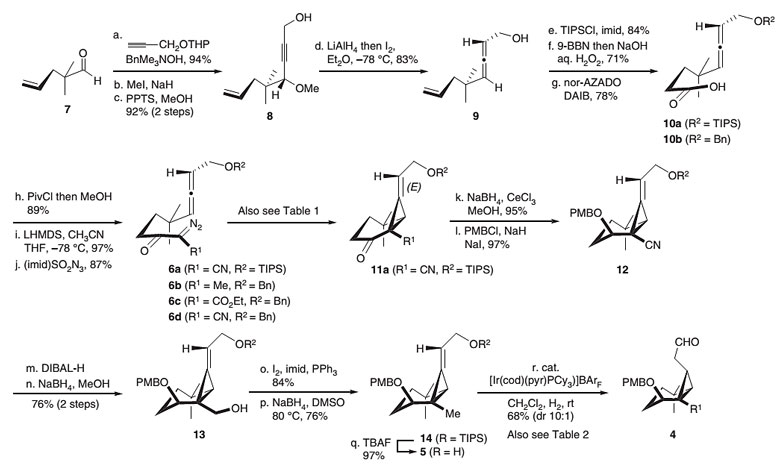
图3. 全顺式取代环丙烷中间体4的合成。图片来源:Nat. Commun.
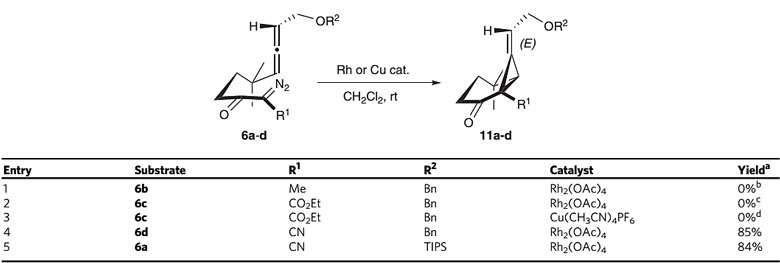
图4. 环丙烷化反应的条件筛选。图片来源:Nat. Commun.
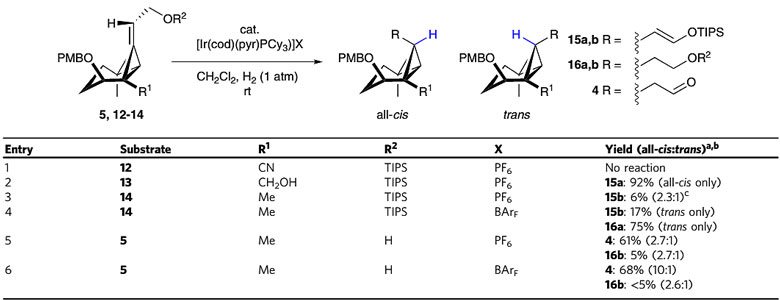
图5. 全顺式取代环丙烷化反应的条件筛选。图片来源:Nat. Commun.
作者还对不同底物发生烯烃异构化的选择性进行了机理解释,从而说明了不同导向基团对产物的选择性影响很大。
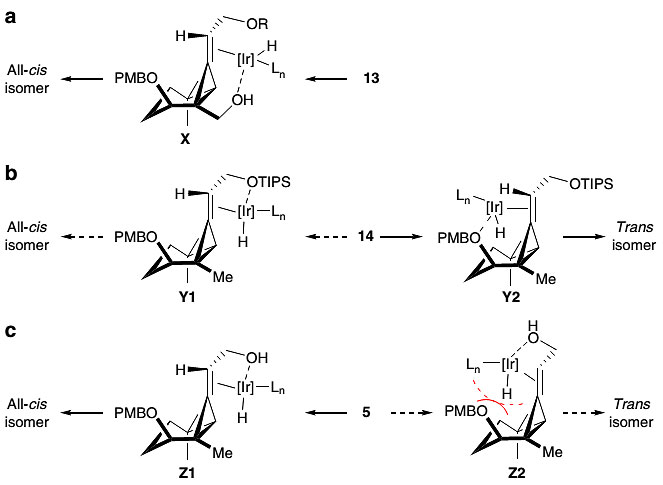
图6. Ir催化烯烃异构化的立体化学。图片来源:Nat. Commun.
顺利得到中间体4以后,作者随后进行C环和D环的构建。首先4通过与甲醛反应在醛的α位引入亚甲基得到不饱和醛中间体,接着进行醛的还原和双键的硼氢化反应得到二醇中间体3。作者随后尝试了一系列条件来实现对两个羟甲基的选择性转化,最终对甲苯磺酸脱颖而出,反应中除了目标产物还生成另外一个羟基进行PMB取代基修饰的产物,而在体系中加入苯硫酚可以消除副产物,并顺利以88%的高收率得到中间体18,体系中没有检测到开环副产物,作者认为环丙基甲基阳离子的π轨道与环丙烷的类sp2轨道形成很好的相互作用。作者随后探讨了四氢吡喃环的C-H键氧化反应,通过一系列的条件筛选,最终使用TFDO得到最好的结果,以96%的分离产率得到中间体22。22接着进行羟基的Ms保护基修饰和氰基取代两步反应将羟基转化为氰基,随后DIBAL-H将羰基还原为醇,接着发生氰基和苯甲酰基的水解,最终顺利得到环化的内酯中间体25,25在酸性条件下消除一分子水得到相应的烯烃中间体2。2进行选择性的双羟基化反应并使用TES保护基选择性保护C3位的羟基得到中间体26,再依序进行甲酰化、亲核取代以及氧化反应三步得到中间体28和C2'-epi-28,它们再进行氢氟酸吡啶盐消除TES保护基顺利得到最终产物1(Avenaol)和C2'-epi-1。其结构通过X射线单晶衍射表征得到证实。
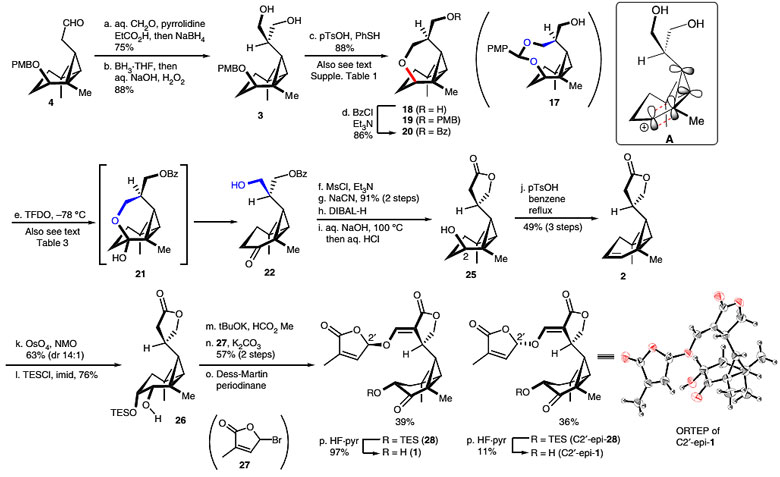
图7. Avenaol的全合成。图片来源:Nat. Commun.
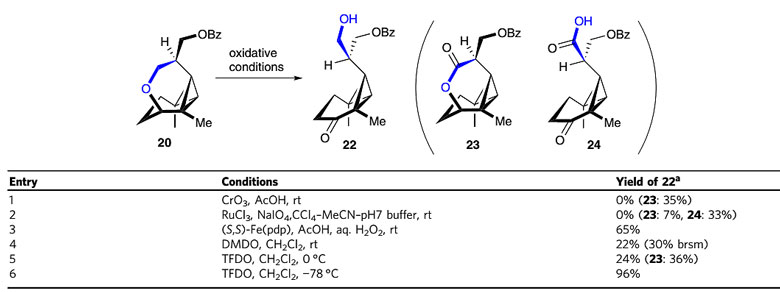
图8. 四氢吡喃环的C-H键氧化。图片来源:Nat. Commun.
——总结——
Chihiro Tsukano研究团队报道了Avenaol的天然产物全合成,其关键步骤是以亚烃基环丙烷作为中间体通过烯烃的选择性异构化构建全顺式取代的环丙烷,由此避免了环丙烷的开环与笼状结构的形成。四氢吡喃环的C-H键氧化也是合成中非常重要的一步。该工作对相关结构天然产物的合成具有重要的借鉴意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total synthesis of avenaol
Nat. Commun., 2017, DOI: 10.1038/s41467-017-00792-1
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号