华理酶库再添新成员,羰基还原更简单
近年来,我国传统的化学化工及相关制造业面临着巨大的环保压力和节能减排的挑战,以工业酶为核心的生物合成技术可以显著降低生产过程中的资源与能源消耗,减少污染物的排放,成为企业创新驱动、转型发展、依法减排所需要的先进制造技术。然而,天然来源的酶通常无法满足实际工业应用环境中的苛刻条件,因此需要对其性能进行提升。近日,华东理工大学生物工程学院生物反应器工程国家重点实验室、上海生物制造技术协同创新中心的许建和课题组针对来源于Candida glabrata 的野生型羰基还原酶CgKR1底物适用性不够广泛、催化活性不够高的缺陷,通过对酶分子结构的理性改造,成功设计出一种广谱、高效的生物催化剂。这一最新研究成果发表于ACS Catalysis 上。

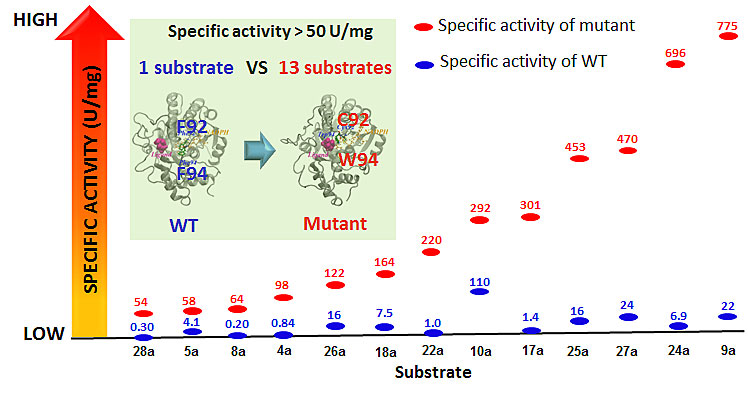
基于分子动力学模拟的底物与CgKR1-WT (A)和CgKR1-F92C/F94W (D)结合模式的对比
研究人员利用计算机辅助的分子动力学模拟分析,发现位于该酶底物通道loop上的92位苯丙氨酸残基与175位酪氨酸催化残基的芳香环之间形成强π-π相互作用,使大位阻的92F稳定在底物进入活性中心的通道上,从而阻碍底物与催化残基的结合。因此,他们推测该氨基酸可能是影响酶活性的一个关键残基。与此同时,研究人员基于长期研究工作的积累(Adv. Synth. Catal., 2012, 354, 1765; Adv. Synth. Catal., 2014, 356, 1943),推测位于底物通道loop上的另一个关键氨基酸残基94F也可能影响酶的活性。基于上述推测,他们对这两个残基进行了突变和活性筛选,获得一种活性显著提高的突变体CgKR1-F92C/F94W。该突变体对28种结构多样性的羰基底物的催化活性均得到显著的提高。其中,纯酶比活力超过50 U•mg–1的底物达到13个,最高可达到775 U•mg–1。作者利用该突变酶作为催化剂,成功实现了多种药物手性中间体的扩大规模制备,底物上载量>100 g/L,ee值高达99%,时空产率为583 g–1•L–1•d–1。此外,他们还通过分子动力学模拟阐明了这两个残基在提升酶活性中发挥的作用机制,对其他类似羰基还原酶的分子改造具有指导意义。这一广谱且高效的生物催化剂为华东理工大学的工业酶库再添新的环境友好不对称催化合成工具。据悉,许建和教授领导的生物催化与合成生物技术团队长期致力于羰基还原酶、亚胺还原酶、单加氧酶、环氧水解酶等工业生物催化剂开发与应用的研究,构建了一个包含千余品种的“千酶库”,为化学、化工、医药、食品及环保等行业的客户量身定制高效专一、自主产权的酶催化剂及相应的绿色合成催化工艺。
上述研究工作由郑高伟副教授率领刘源炀同学和陈琦博士等协作完成。郑高伟博士作为许建和团队的青年核心成员之一,在Curr. Opin. Biotechnol.、Chem. Commun.、Org. Lett.、Adv. Synth. Catal.、ChemCatChem 等国际高影响力的学术期刊上发表学术论文36篇,主持承担“手性胺酶促合成与催化机制解析”等国家自然基金项目2项,“973计划”、“863计划”项目子课题及企业合作课题5项。此外,该研究工作还得到中央高校基本科研业务费专项资金和上海市浦江人才等项目的资助。
该论文作者为:Gao-Wei Zheng, Yuan-Yang Liu, Qi Chen, Lei Huang, Hui-Lei Yu, Wen-Yong Lou, Chun-Xiu Li, Yun-Peng Bai, Ai-Tao Li and Jian-He Xu
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Preparation of Structurally Diverse Chiral Alcohols by Engineering Ketoreductase CgKR1
ACS Catal., 2017, 7, 7174, DOI: 10.1021/acscatal.7b01933
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号