JACS:首次不对称全合成Nigelladine A
选择性C-H键官能团化的不断发展极大地推动了有机化学研究的进步,其中C-H键的直接化学氧化是最重要的化学转化之一。该方法无需通过官能团的相互转化,可直接获得氧化中间体。尽管该领域的研究取得了一些进步,但C-H键氧化反应的区域选择性问题仍旧需要解决。二萜类生物碱Nigelladines A–C和吡咯并喹啉类生物碱Nigellaquinomine是最近分离的两类天然产物。以Nigelladine A为例,C7位的酮羰基理论上可通过后期修饰的C-H键氧化来构建,尽管人们发展了多种烯丙基位的C-H键氧化反应,但在C7位的二级碳发生氧化的同时伴随着C10位三级碳氧化的竞争过程,相关选择性C-H键氧化的报道十分少见。Nigelladine A的C7位通过后期修饰的C-H键氧化引入酮羰基十分具有挑战性。
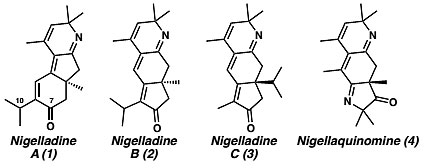
图1. 天然产物Nigelladines A–C和Nigellaquinomine的结构。图片来源:J. Am. Chem. Soc.
与传统的催化反应相比,酶催化的氧化过程具有非常好的区域选择性。但受其催化专一性的限制,底物的适用范围较为局限,因而在天然产物全合成中的应用往往被忽视。最近,美国加州理工学院的Frances H. Arnold教授(点击查看介绍)和Brian M. Stoltz教授(点击查看介绍)等人利用基因工程改造的细胞色素P450酶催化选择性烯丙基C-H键氧化,成功实现了Nigelladine A的首次全合成(图2)。
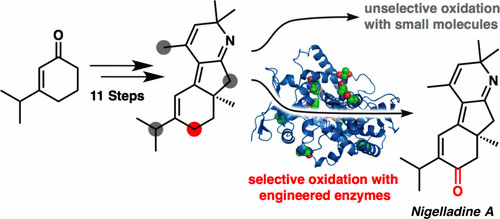
图2. 天然产物Nigelladine A全合成。图片来源:J. Am. Chem. Soc.
作者首先对Nigelladine A进行了逆合成分析。Nigelladine A可由中间体5的C7位通过选择性烯丙基为C-H键氧化来实现,而5可以通过6和7两个片段的Suzuki-Miyaura反应及后续缩合形成亚胺来合成,中间体7可以通过中间体8的Wacker氧化/Aldol反应来制备,8可以通过中间体9的不对称烯丙基烷基化反应来实现,中间体9可以通过中间体10来制备,10可以由简单的原料1,3-环己二酮通过Stork-Danheiser反应来合成(图3)。
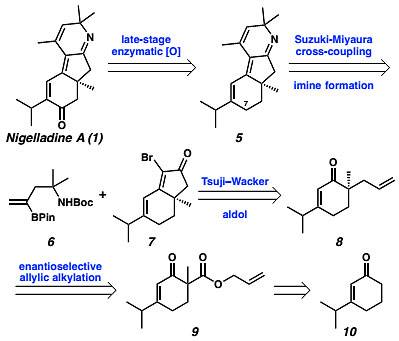
图3. 逆合成分析。图片来源:J. Am. Chem. Soc.
作者首先对中间体二烯酮13进行了合成。不饱和酮10与二甲基肼反应以91%的产率得到腙中间体11,中间体11随后在碱的参与下进行酰化反应,随后腙在酸性条件下发生水解,羰基α位甲基化得到中间体9,三步反应总收率达到73%。中间体9在Pd2(dba)3/(CF3)3-t-Bu-PHOX的催化下发生不对称烯丙基化烷基化反应,以96%的产率和87%的对映选择性得到烯酮中间体8,8在PdCl2/CuCl催化下发生经典的Tsuji–Wacker氧化反应,随后进行Aldol缩合反应得到中间体12,两步总收率76%。中间体12在NBS的作用下发生选择性溴代反应以83%的收率得到烯基溴中间体7。中间体7与6在XPhos Pd G2的催化下发生Suzuki-Miyaura反应以88%的产率得到中间体13(图4)。
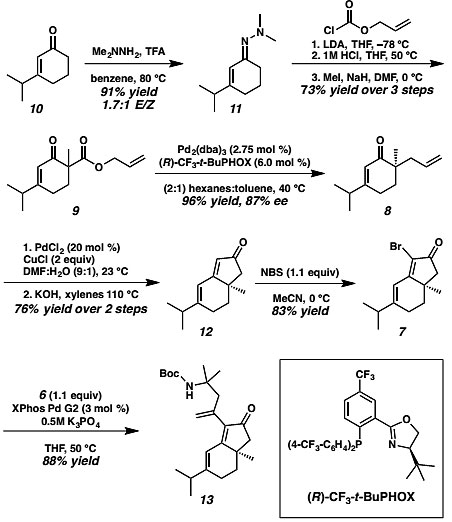
图4. 中间体二烯酮13的合成。图片来源:J. Am. Chem. Soc.
作者随后对亚胺中间体5进行了合成。中间体13在TFA作用下消除Boc保护基,随后用碳酸氢钠水溶液淬灭的同时发生缩合环化,并在SiO2的作用下发生环外双键异构化得到环内双键的亚铵盐中间体5•TFA(图5)。
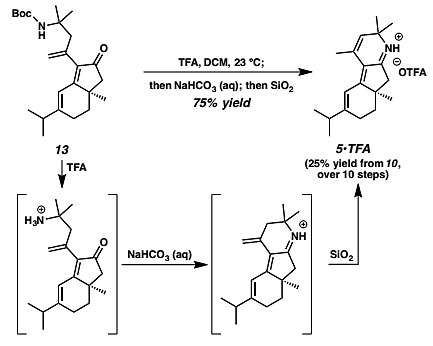
图5. 亚铵盐5•TFA的合成。图片来源:J. Am. Chem. Soc.
顺利得到亚胺中间体5以后,作者尝试了一系列的化学氧化条件,然而遗憾的是,在目标C7位点发生氧化的比例很少,除此之外不仅观察到单氧化产物,还观察到过氧化产物(图6)。
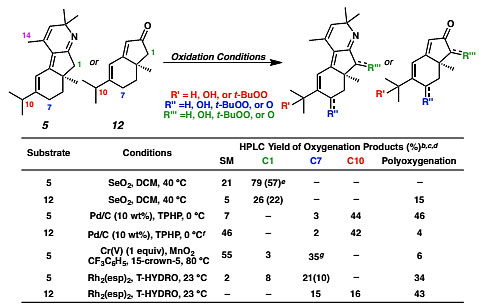
图6. 化学氧化的尝试。图片来源:J. Am. Chem. Soc.
作者随后将目光转移到酶催化氧化的方法。其中选择P450 8C7工程酶具有良好的效果,以2.8/1的化学选择性得到目标氧化产物(图7)。
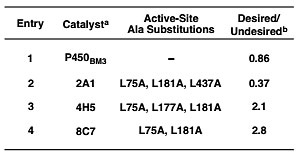
图7. 不同P450酶的催化氧化。图片来源:J. Am. Chem. Soc.
最终中间体5在P450 8C7酶的作用下顺利发生C7位点的C-H键氧化反应得到醇中间体,并在DMP的氧化条件下以两步21%的总收率完成了Nigelladine A的合成(图8)。
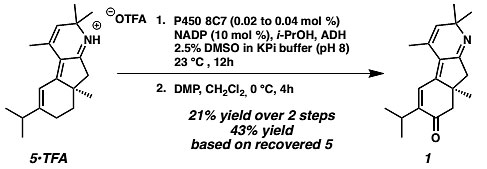
图8. Nigelladine A的合成。图片来源:J. Am. Chem. Soc.
——总结——
Frances H. Arnold教授和Brian M. Stoltz教授等人报道了以12步线性步骤,5%的总收率完成了Nigelladine A的首次不对称全合成。P450 8C7酶的使用成功解决了后期C7位C-H键氧化的化学选择性及区域选择性的问题。我们相信酶催化反应在全合成的后期转化中将发挥越来越重要的角色。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective Total Synthesis of Nigelladine A via LateStage C–H Oxidation Enabled by an Engineered P450 Enzyme
J. Am. Chem. Soc., 2017, 139, 10196, DOI: 10.1021/jacs.7b05196
导师介绍
Frances H. Arnold
http://www.x-mol.com/university/faculty/438
Brian M. Stoltz
http://www.x-mol.com/university/faculty/471
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号