活性共价化学标记-质谱分析蛋白质复合物局部微观结构
现阶段蛋白质结构分析表征主要通过X射线晶体衍射、冷冻电镜、核磁共振等方法进行,但这些技术对样品的纯度和用量要求高、表征通量低。近年来质谱已经成为蛋白质结构分析表征的重要补充,具有灵敏度高、可分析复杂混合物、可高通量动态分析等特点。现有的质谱技术在表征蛋白质复合物结构时通常需要使用双官能团分子进行化学交联,然后通过交联多肽的鉴定获得蛋白质亚基之间的位置结构信息。在进行酰化等化学交联反应后,蛋白质复合物通常已经不再具备生物活性。
活性状态下,生物体中的赖氨酸通常带正电,对于稳定蛋白质结构、调控蛋白质功能具有至关重要的作用。由于掩埋带电氨基酸需要较大能量,因此多数的赖氨酸都位于蛋白质表面,而一些位于蛋白-蛋白相互作用界面的赖氨酸则与周围基团形成氢键或静电相互作用。因此,考察蛋白质复合物内赖氨酸的局部微观环境对于了解活性状态下的蛋白结构和功能十分重要。现阶段还没有能够系统分析蛋白质复合物内部活性赖氨酸局部微观结构的方法。
中国科学院大连化学物理研究所的王方军研究员(点击查看介绍)团队通过将活性二甲基化共价化学标记和质谱技术相结合的方法,很好的弥补了上述缺憾。通过甲醛和氰基硼氢化钠对赖氨酸侧链上的伯胺进行还原二甲基化标记反应是一种高效稳定的共价化学标记方法,在核磁共振和X射线晶体衍射的研究中,已经证实这种方法不会改变蛋白质的结构与活性。此外,二甲基化标记后赖氨酸残基的带电状态不改变,所以这种方法也几乎不会引入人为的蛋白质构象变化和蛋白-蛋白相互作用。裸露在蛋白质表面的自由赖氨酸和包埋在蛋白质内部或参与相互作用的赖氨酸相比,能够更加容易、快速地被标记。因此,赖氨酸的标记效率就代表着它们在微观局部环境中与周围氨基酸残基的相互作用(氢键和静电相互作用)强度。

图1. 蛋白质赖氨酸侧链氨基活性二甲基化共价标记策略示意图。位于蛋白质表面的“自由”赖氨酸更容易被标记,位于蛋白质相互作用界面的赖氨酸由于氢键和静电相互作用等较难被标记。标记后赖氨酸电荷状态不变,仍然保持其原有生理结构和生物活性。菠菜PSII复合物在进行高度标记(所有赖氨酸标记效率均大于85%)后仍然保持高放氧活性(1000 μmol O2 (mg of chlorophyll)-1h-1, 原有活性的77%)。
这一方法应用在蓝细菌、红藻和菠菜的光系统II(photosystem II, PSII)蛋白质复合物局部微观结构对比分析中。在三个物种间,总共鉴定到121个标记效率不同的赖氨酸;物种间标记效率一致的赖氨酸主要集中于PSII蛋白质复合物的lumen区域,并且位于与氧释放相关的蛋白质亚基(PsbB、PsbC、PsbD、PsbO)的相互作用界面上。通过活性二甲基标记结合质谱分析的方法考察膜蛋白质复合物内赖氨酸的微环境,为深入了解进行光合作用的不同物种间PSII蛋白质复合物上的保守和非保守结构信息提供了依据。
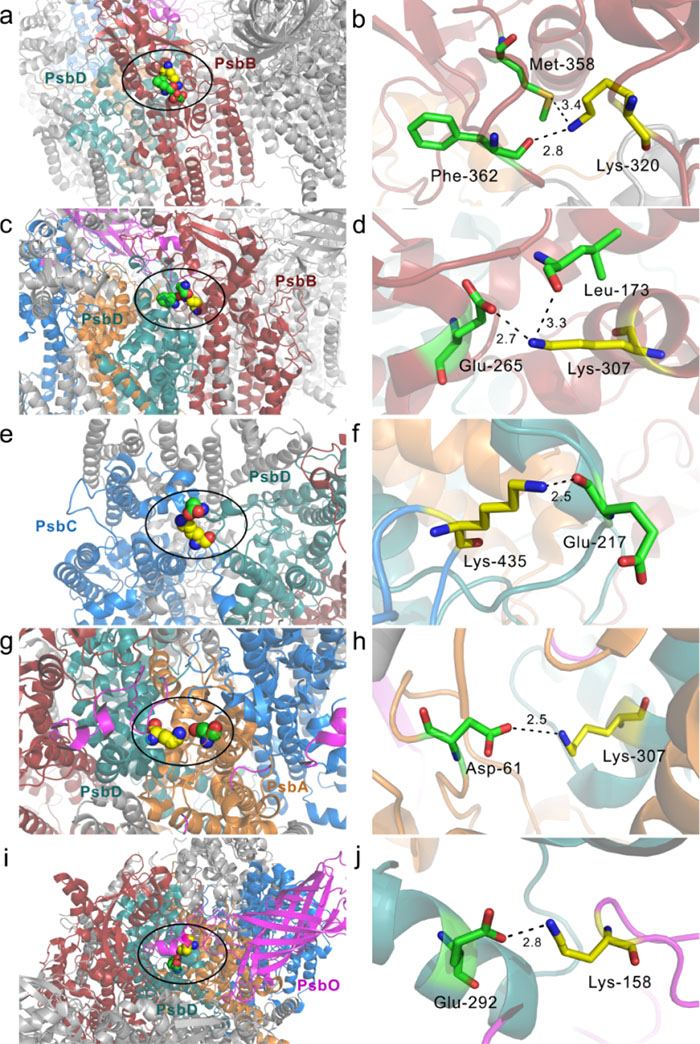
图2. 在蓝藻、红藻、菠菜PSII复合物活性标记分析中高度一致性的低标记赖氨酸所处微观局部结构图。PsbB-Lys-320 (a, b), PsbB-Lys-307 (c, d), PsbC-Lys-435 (e, f), PsbD-Lys-307 (g, h), PsbO-Lys-158 (i, j)。由于其所处环境中存在较强的氢键和静电相互作用,标记进程相对较慢,标记程度较低。
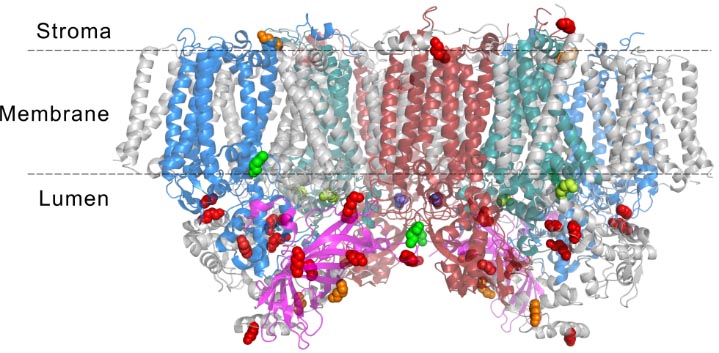
图3. 在蓝藻、红藻、菠菜PSII复合物活性标记分析中标记效率一致的赖氨酸的结构分布图。主要集中于PSII蛋白质复合物的lumen区域,并且位于与氧释放相关的蛋白质亚基(PsbB、PsbC、PsbD、PsbO)的相互作用界面上。这也从侧面表明这四个蛋白质亚基在不同物种中具有较高的保守性。
这一成果近期发表在《Analytical Chemistry》上,文章的第一作者是中国科学院大连化学物理研究所博士研究生周烨和吴越。
该论文作者为:Ye Zhou, Yue Wu, Mingdong Yao, Zheyi Liu, Jin Chen, Jun Chen, Lirong Tian, Guangye Han, Jian-Ren Shen, Fangjun Wang
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Probing the Lysine Proximal Microenvironments within Membrane Protein Complexes by Active Dimethyl Labeling and Mass Spectrometry
Anal. Chem., 2016, 88, 12060-12065, DOI: 10.1021/acs.analchem.6b02502
王方军研究员简介

王方军博士,中国科学院大连化学物理研究所研究员。2005年6月于浙江大学获学士学位,2011年7月于中国科学院大连化学物理研究所获博士学位(导师:邹汉法研究员),其中2010年1月至2011年3月于加拿大渥太华大学系统生物学研究所联合培养(合作导师:Daniel Figeys教授)。2011年9月破格获得大连化学物理研究所“百人计划”资助。曾获中国科学院优秀博士学位论文(2012年),UCAS-Springer优秀博士学位论文(2013年),入选中国科学院青年创新促进会(2014年)。主要从事蛋白质、修饰蛋白质、蛋白质复合物液相色谱-质谱分析表征新方法研究,以第一作者/通讯作者发表SCI论文30余篇, SCI他引1300余次。担任中国蛋白质组学专业委员会理事,中国分析测试协会青年学术委员会委员等协会职务。
http://www.x-mol.com/university/faculty/38322
