J. Med. Chem. 2015-2016年度“技术表彰大会”
人类和疾病的斗争已经进行了成千上万年,也还将无期限的持续下去。在这个没有硝烟的战场,药物化学家是维护人类健康、抵抗各类疾病的中流砥柱。但是,药物发现之路并不是一番坦途,药物化学家要面对很多难以想象的艰险挑战。发展新技术以及巧妙应用各种技术能够帮助药物化学家更有效率的克服困难,找到更多对抗疾病的理想药物。J. Med. Chem.编辑部挑选了2015-2016年有代表性的6篇文章[1],希望能给药化领域带来一些思考和启发。

首先是基于片段的药物发现(fragment-based drug discovery,FBDD)。FBDD一直是用于鉴定新型苗头化合物的关键技术,涉及靶标包括难以施药的靶标,例如蛋白质-蛋白质相互作用(PPI)。发展更好的方法来确定那些蛋白-片段的弱、非共价相互作用,对于FBDD十分重要。下列文章中的前两篇,相信是很好的例子。
1. 天然状态质谱与碳酸酐酶II抑制剂[2]
碳酸酐酶II是一种催化二氧化碳的可逆水合为碳酸氢根和质子的锌酶。Woods等人在这项工作中,采用了一种较为少见的片段筛选技术——天然状态质谱(native state mass spectrometry),结合表面等离子体共振(SPR)和X射线晶体学(XRC)来筛选与碳酸酐酶II结合的片段。天然状态质谱可以直接观测天然状态的蛋白质和蛋白质复合物,只需消耗少量的蛋白质和配体,不需要标记,也不需要样品固定、色谱分离或将配体从蛋白质中分离出来,从而节约时间,快速识别。Woods等人的片段筛选分为两个阶段。第1阶段,从含720个片段结构(相对分子量100-350 Da)的CSRIO库中筛选出了7个片段,其中包括一种非经典的碳酸酐酶II结合化学型,三类方法得到的结果基本一致(图1)。第2阶段从含量超过50,000的化合物库中筛选出70个化合物,包含6种化学片段类型,其中37个可作为苗头化合物。
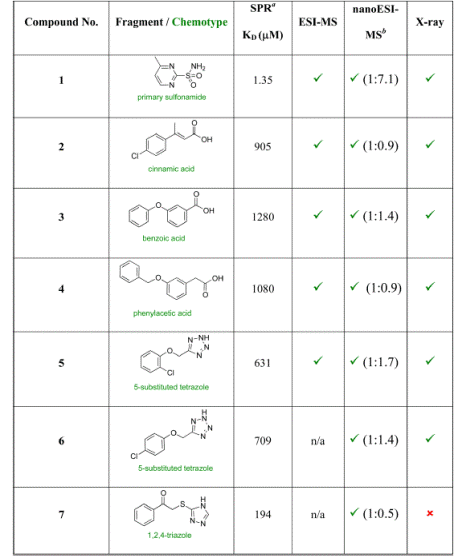
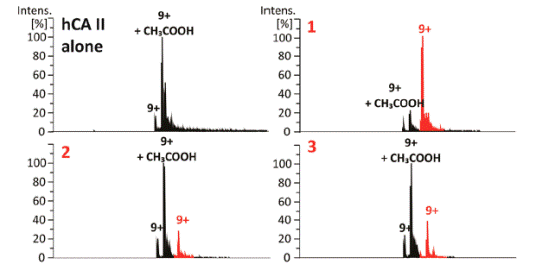
图1. 片段筛选及蛋白质-小分子复合物质谱。图片来源:J. Med. Chem.
这一工作充分说明,天然状态质谱可以作为一种补充方法用于片段筛选,以加速药物发现进程。
2. BCATm抑制剂的筛选[3]
线粒体支链氨基转移酶(BCATm)是一种代谢酶,将支链氨基酸(如亮氨酸、缬氨酸和异亮氨酸)转化为对应的α-酮酸。因该酶和肥胖症相关,有望作为治疗肥胖症和相关疾病的靶蛋白,但其抑制剂较难开发。Bertrand和同事们结合片段筛选和高通量筛选(HTS)来鉴定和优化BCATm抑制剂。Bertrand等人使用了多种技术:饱和转移差谱核磁共振(STD-NMR)、溶解热(Tm)、生化分析以及XRC。进行片段筛选时,所得的化合物结构最好多种多样,这样就识别尽可能多的结合口袋,彼此之间不干扰或重叠。经典筛选方式是用生化分析和晶体结构来识别,通过优化使初始的弱结合片段逐渐成长为强效的先导化合物。但这种方法是在蛋白质存在一种构象的基本假设下,而蛋白在溶液中是不断变化的,这样提供了多种结合机会。BCATm就存在PLP和PMP两种状态。Bertrand等人首先从1,056个化合物中同步进行三种筛选,过程见图2:
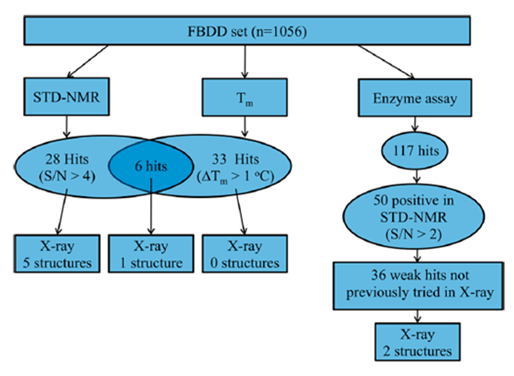
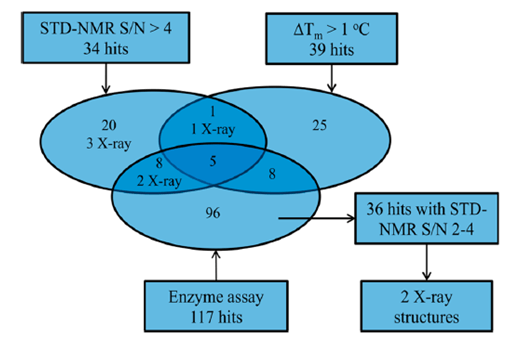
图2. FBDD筛选过程和结果。图片来源:J. Med. Chem.
随后从这些片段中对4种结构再次研究,着重对片段4进行了优化,如提高溶解性等,以作为潜在的片段继续研究(图3)。
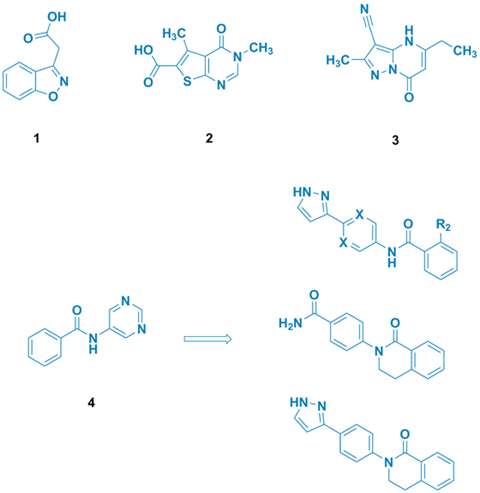
图3. 片段结构代表和片段4的继续优化。图片来源:J. Med. Chem.
3. DNA编码的小分子库与RIP1抑制剂[4]
受体相互作用蛋白1(RIP1)的激酶活性在肿瘤坏死因子(TNF)介导的炎症中起重要的启动作用。因此抑制RIP1的活性,有希望治疗多种炎症相关疾病。虽然已有些抑制剂报道,如5-7(图4),但效果和药代动力学表现都不理想。GSK的科学家Harris等人首先筛选了公司激酶项目中的化合物库,确定了一系列RIP1抑制剂,但都存在分子量大、亲脂性高、水溶性差的问题,还有脱靶的风险。扩大化合物库(200万化合物)发现苗头化合物8(GSK’963,图4),但啮齿类动物实验发现口服效果不好,前景不明。
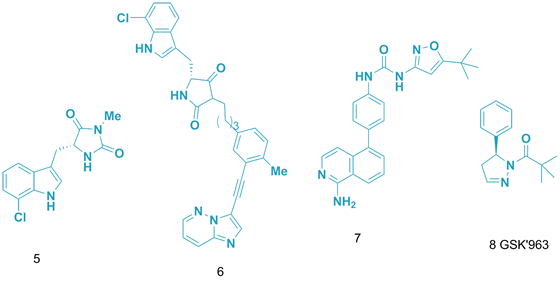
图4. RIP1抑制剂。图片来源:J. Med. Chem.
为开发新颖的化学结构,Harris等人动用了自家的“核武器”——DNA编码的小分子化合物库,通过三元合成砌块(BB1、BB2和BB3,BB = Building Block)和均分与合并(split-and-pool)的组合化学策略,得到庞大的77亿容量的化合物库(见图5)。其中BB1对亲和力贡献不大,BB2和BB3组成的酰胺化合物成为苗头化合物,并最终发现了一系列的benzoxazepinone化合物作为RIP1抑制剂,它们同时具有高活性和高选择性,以及良好的口服药代动力学参数。
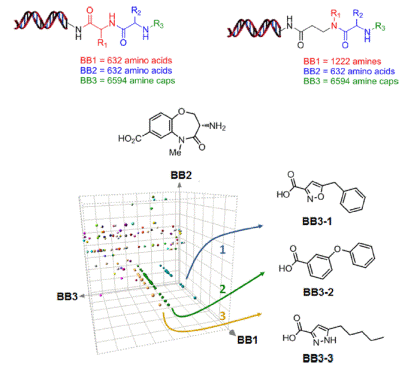
图5. (上)三元氨基酸化合物库,(下)选择输出的立方体视图。图片来源:J. Med. Chem.
其中,化合物GSK’481(图6)在456种激酶中仅对RIP1激酶有效,表现出非常优秀的选择性,共晶结构显示除苄基插入到疏水口袋外,还存在酰胺键中的NH和ASP156残基的氢键作用,GSK’481有望成为临床候选药物。
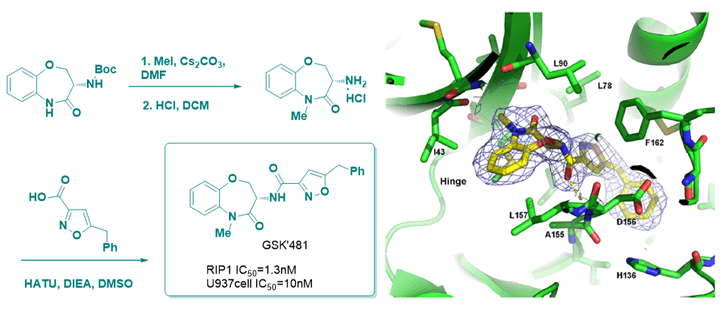
图6. GSK’481的合成路线、结构以及和RIP1的共晶结构。图片来源:J. Med. Chem.
DNA编码的小分子化合物库投入巨大,不过多家制药巨头都独立或者合作建立了这种化合物库。一直以来都有针对DNA编码的小分子化合物库实用性的质疑,Harris等人的工作算是为它正了名。
4. 确定白介素IL-17的结合口袋[5]
白介素17(IL-17)是由T辅助性细胞产生的炎症因子,通过结合在I型细胞表面的受体IL-17R起作用,可与TNF和白介素1协同促进炎症,与一些自身免疫疾病有关,如银屑病等。因此,开发一些调节IL-17功能的药物也受到医药界的关注。
IL-17存在两种结合口袋:β发夹口袋和α螺旋口袋,其中有假说认为β发夹口袋是大环类多肽的结合位点。Espada等人使用了很有吸引力却未广泛应用的氢氘交换质谱(HDX-MS)来研究IL-17A上的小分子结合位点,结果支持了这种假说。
IL-17A的晶体结构已被解析,但迄今为止,还没有任何和小分子化合物的共晶报道。Ensemble Therapeutics公司的大环多肽类化合物9-11(图7)是近来报道的拮抗剂。
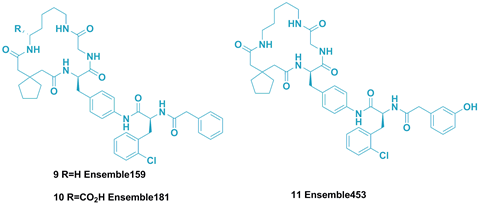
图7. 大环多肽类化合物9-11。图片来源:J. Med. Chem.
HDX-MS的机理简而言之:将蛋白质或其复合物浸入到重水缓冲液中,蛋白质结构酰胺键中的氢原子与重水中的氘原子发生交换反应,交换反应进行之后的样品进行酶切,进而通过质谱检测确定蛋白质的不同序列片段的氢氘交换速率,如图8所示。一般而言,涉及的骨架酰胺氢在弱氢键或位于蛋白质表面可迅速交换,而内部或涉及稳定氢键的交换较慢,从而得出蛋白质的空间结构信息。

图8. HDX-MS的流程图。图片来源:J. Med. Chem.
结果证明,IL-17A和Ensemble 159(化合物9)复合物在多肽序列的90-101、92-99处(正好在β发夹区间)的氘交换率低于IL-17A,说明结合在IL-17A的β发夹口袋,而不是α螺旋口袋,从而为开发IL-17的拮抗剂提供了成药靶点。
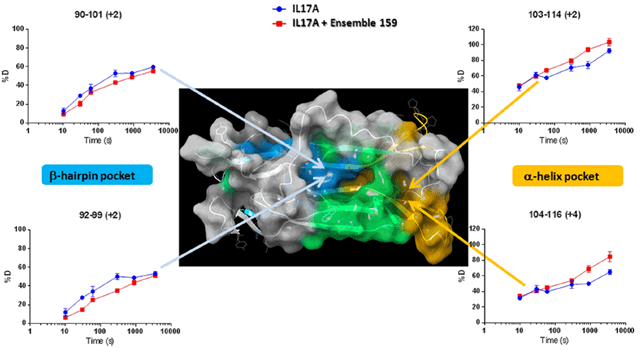
图9. IL-17A、IL-17A和Ensemble159复合物的氘交换率。图片来源:J. Med. Chem.
5. 凝血因子FIXa抑制剂代谢产物分析[6]
研究药物代谢产物是药物发现过程中的常用方式,特别是药物的药代动力学不够理想时,代谢产物可为科学家提供思路,抑制代谢以提高药代动力学性质。有时,代谢产物的活性比母体分子还要高。因此理解代谢产物的特点和规律,有助于更好的设计分子。在药物研发中,代谢产物可以在体外由肝脏细胞中和/或微粒体中进行,也能从动物或人类体内的尿液或血样中获得,但后者依赖于LC-MS的灵敏度,以及MS-MS的能力。要确定一个结构,还需要NMR分析,传统方法是通过大量制备,然后分离提纯。这些方法鉴定的都是主要代谢产物,那些微量的代谢产物可能被忽略。现在随着MicroCryoProbe NMR分析能力的提升,代谢产物的用量减少,或许能成为构效关系(SAR)研究的新方法。
Zhang等人使用自动配体识别系统(ALIS),结合亲和力选择质谱(AS-MS),研究了凝血因子FIXa抑制剂的代谢产物。将先导化合物12在肝脏微粒体中培育,产生代谢产物,培养后的混合物不需分离每个代谢产物,就能得到亲和力排名。并且,经过微分离设备提纯后得到的微克级代谢产物,再经过MicroCyroProbe异核二维NMR确定结构。这些代谢产物再重新进行FIXa酶活性测试,结果与ALIS得到的一致(图10-12)。
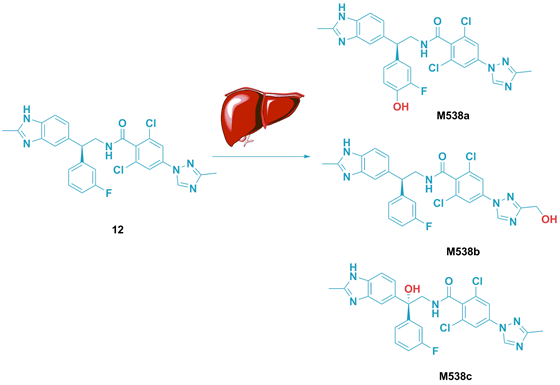
图10. 先导化合物12在肝脏中的代谢产物结构。图片来源:J. Med. Chem.
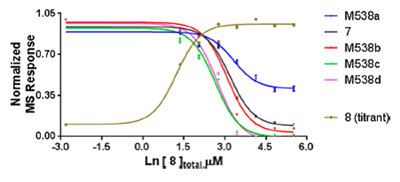
图11. 化合物12及代谢产物的ALIS亲和力排名M538a > 7 > M538b > M538c、M538d。图片来源:J. Med. Chem.
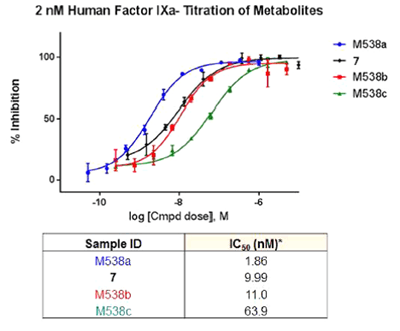
图12. 化合物12及代谢产物的FIXa活性滴定曲线和IC50值,M548a的活性最高,与ALIS一致。图片来源:J. Med. Chem.
这一工作证明ALIS可用来预测代谢产物的活性,避免了传统的分离、表征、再合成、体外活性测试等复杂过程,从而可以加速药物发现。
6. COMT抑制剂的脱靶效应[7]
儿茶酚-O-甲基转移酶(COMT)是神经递质儿茶酚胺的氧甲基化酶,作为治疗外围和中枢神经系统错乱的靶标而广受关注。COMT抑制剂Tolcapone和Entacapone可用于帕金森症的治疗。Tolcapone虽疗效更好,但因肝毒性在有些国家已经退市;Entacapone毒性尚可接受,但生物利用度不好。因此,理解Tolcapone引起毒性的毒理学,有利于开发更有效的COMT抑制剂。为阐明tolcapon的脱靶效应,需要测试一系列脱靶蛋白,从整个蛋白质组学去考虑。为此Kleist等人设计并运用了区分竞争捕获化合物质谱(differential competition capture compound mass spectrometry,dCCMS)策略,来研究化合物的脱靶效应(图13)。

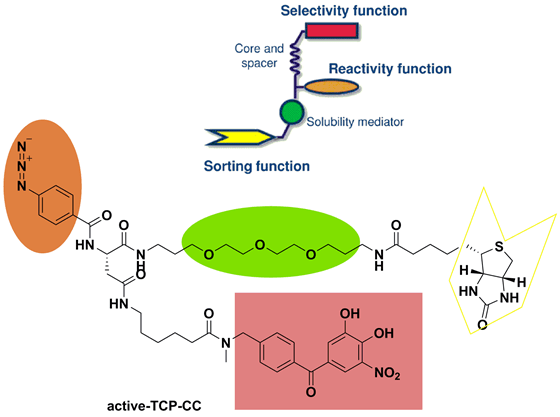
图13. COMT抑制剂和Tolcapone捕获化合物的结构。图片来源:J. Med. Chem.
捕获化合物质谱法(CCMS)的工作原理为:首先具有选择性功能的基团(药物药效团)通过可逆的作用力与目标蛋白质分子相结合,然后光敏化作用(叠氮部分)在光照下与目标蛋白质分子之间通过共价键相结合,最后目标蛋白被生物素部分捕获分离,再通过质谱分析法鉴别。dCCMS是其增强版,通过剂量依赖型的CCMS,识别对不同蛋白的结合能力(图14)。
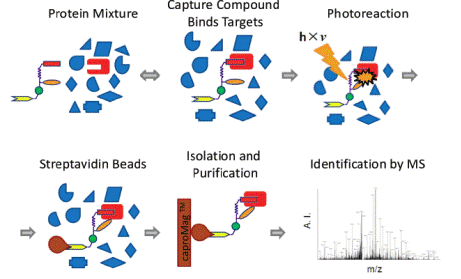
图14. CCMS的工作原理。图片来源:J. Proteome Res.[8]
在肝癌细胞HepG2细胞液中,通过dCCMS识别了Tolcapone的主要靶标COMT和脱靶蛋白3-羟基异丁酸CoA水解酶(HIBCH),Tolcapone与后者的结合或是其毒性的起源,而毒性较小的Entacapone不与HIBCH结合。基于结构设计的新型化合物15和16(图13)被确认为强效COMT抑制剂,被进一步用于研究与COMT和HIBCH的构效关系。化合物16无此副作用,或许可以作为研发高特异性COMT抑制剂的起点。
结语:以上文章所涉及的各种技术及其应用,是不是让人有耳目一新的感觉呢?药物化学,或许就是在这些新技术的运用更新中而不断前行的。
参考文献:
[1] J. Med. Chem., 2016, DOI: 10.1021/acs.jmedchem.6b01600
[2] J. Med. Chem., 2016, 59, 2192-2204, DOI: 10.1021/acs.jmedchem.5b01940
[3] J. Med. Chem., 2016, 59, 2452-2467, DOI: 10.1021/acs.jmedchem.5b01607
[4] J. Med. Chem., 2016, 59, 2163-2178, DOI: 10.1021/acs.jmedchem.5b01898
[5] J. Med. Chem., 2016, 59, 2255-2260, DOI: 10.1021/acs.jmedchem.5b01693
[6] J. Med. Chem., 2016, 59, 1818-1829, DOI: 10.1021/acs.jmedchem.5b01293
[7] J. Med. Chem., 2016, 59, 4664-4675, DOI: 10.1021/acs.jmedchem.5b01970
[8] J. Proteome Res., 2010, 9, 806-817, DOI: 10.1021/pr9007333
