脲催化的立体选择性Koenigs-Knorr糖基化反应
糖类化合物不仅在生命体内是重要的结构和能源物质,而且在许多生理和病理过程中都发挥着重要作用。化学合成是得到这些糖类化合物的重要手段,发展高效、高立体选择性的糖基化方法是提高寡糖类化合物合成效率的关键。作为经典的糖基供体之一,卤代糖具有容易制备、操作简单等优点。但是,卤代糖通常要用到银、汞等重金属盐作为活化剂,这在很大程度上限制了该类糖基供体的应用。近年来快速发展的利用弱相互作用活化卤代物的作用模式,因其条件温和、绿色环保等特点而引起了合成化学家的广泛关注;然而该模式却未被应用于卤代糖的活化。
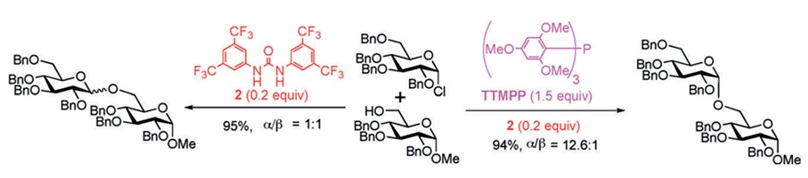
近日,北京大学天然药物及仿生药物国家重点实验室叶新山课题组针对基于卤-氢键活化模式的卤代糖糖基化反应进行了研究,利用1,3-二(3,5-二(三氟甲基)苯基)脲为催化剂以及三-(2,4,6-三甲氧基苯基)-膦(TTMPP)为添加剂,首次实现了脲催化的立体选择性Koenigs-Knorr糖基化反应。初步机理研究表明,糖基供体与脲可能通过卤-氢键作用而发生糖基化反应,而 TTMPP 可能从糖基供体 β-面通过非共价键作用形成络合物从而实现了高 α 立体选择性。该方法克服了现有卤代糖供体糖基化方法严重依赖重金属盐的缺点,为寡糖的立体选择性合成提供了新的选择。

叶新山 教授
这一研究成果发表于《德国应用化学》(Angew. Chem. Int. Ed., 2016, 55, 5221-5224)上,第一作者是硕士生孙丽凤。
该研究工作得到了国家科技部“973”项目、国家自然科学基金重点项目、北京市自然科学基金及北京高校青年英才计划项目的资助。
http://onlinelibrary.wiley.com/doi/10.1002/anie.201600142/full
原文:Stereoselective Koenigs–Knorr Glycosylation Catalyzed by Urea
Angew. Chem. Int. Ed., 2016, 55, 5221-5224. DOI: 10.1002/anie.201600142
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号