基于苯并吡咯酮结构的天然蛋白质修饰新方法
天然蛋白质的化学修饰是化学生物学与药物研究中的重要课题。通过化学反应在蛋白质的侧链或端基引入修饰基团形成缀合物,在生物探针合成、蛋白质结构分析、药物载体靶向输运和蛋白质药物代谢行为改进等方面具有广泛的应用。由于天然蛋白质含有氨基、巯基、羧基等反应性官能团,不具有通过生物工程方法方可引入的叠氮或炔基等基团,因而对其进行选择性修饰具有较高的挑战性。
高效的蛋白质化学修饰反应需要满足若干条件,如反应条件温和(以生理条件pH和温度为最佳),反应体系简单(以无需催化剂为佳),对蛋白质侧链或末端官能团(如氨基或巯基)具有化学选择性,且反应引入的连接基团不破坏蛋白质的高级结构。在现有文献报道中,以N-羟基琥珀酰亚胺(NHS)活泼酯(针对氨基)和马来酰亚胺衍生物(针对巯基)最为常见。
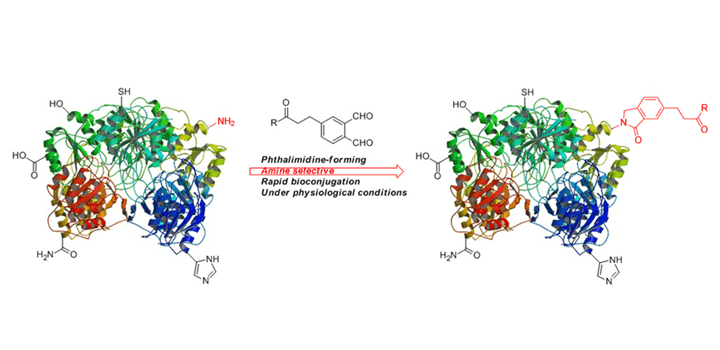
近日,香港大学化学系的李学臣副教授课题组发展了一种基于苯并吡咯酮结构(phthalimidine)新型蛋白质修饰反应,简称PT ligation。该课题组合成的一系列邻苯二甲醛(ortho-phthalaldehyde)衍生物,发现其在室温及近中性的PBS缓冲溶液体系(pH 7.4)中与蛋白质侧链氨基发生缩合反应,转化率接近100%。在相同条件下,与传统的NHS活泼酯方法相比,该反应具有更快的反应速率和更高的选择性(与半胱氨酸,丝氨酸和组氨酸等残基侧链无反应)。另外,该反应具有简单操作、无副产物、无水解性、高效性、高选择性等特点,因而应用前景良好。
该课题组将此方法应用于活性蛋白L-Asparaginase的PEG修饰,在基本保持天然蛋白的催化活性的前提下,显著提高了其对胰蛋白酶水解的稳定性。同时,该课题组通过制备表面修饰有邻苯二甲醛基团的Rink Amide树脂颗粒,成功实现了荧光蛋白RFP在颗粒表面的固载化。
该研究成果近期报道于《Organic Letters》。
http://pubs.acs.org/doi/abs/10.1021/acs.orglett.6b00983
原文:Traceless and Chemoselective Amine Bioconjugation via Phthalimidine Formation in Native Protein Modification
Org. Lett., 2016, 18, 2600-2603. DOI: 10.1021/acs.orglett.6b00983
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号