Astellifadiene:绝对构型确定以及生物合成
日本东京大学Ikuro Abe教授和Makoto Fujita教授等人在从裸胞壳属Emericella variecolor NBRC 32302中寻找萜类合成酶基因和其在米曲霉中的基因功能表达过程中,发现了一个具有6/8/6/5环系的新二倍半萜astellifadiene(1)。通过NMR技术和Fujita发明的晶体海绵法(点击阅读相关)确证了astellifadiene的绝对构型。他们还通过体内和体外的同位素介入实验,提出了astellifadiene的生物合成途径。(Astellifadiene: Structure Determination by NMR Spectroscopy and Crystalline Sponge Method, and Elucidation of its Biosynthesis. Angew. Chem. Int. Ed., 2016, 55, 5785-5788, DOI: 10.1002/anie.201601448)
近几十年来,微生物的基因测序取得蓬勃发展,由此验证了微生物具有产生目标化合物的潜力。这些基因数据不仅可用于快速鉴定已知化合物,还可用于新化合物的发现。由此,大量文献报道了分离未知化合物的方法和应用。随着大量的天然产物的发现,为满足快速鉴定天然产物结构的需求,对先进技术的发展有着迫切需求。确定化合物的平面结构和相对构型通常依赖于核磁共振波谱和质谱技术。然而,对于如何确定化合物的绝对构型还是存在着很大的挑战。晶体海绵法应运而生,用途广泛,甚至对于微量油状物亦可采用X-射线晶体学分析技术进行绝对构型确定。
近年来,基因组采掘和真菌的二萜/二倍半萜合成酶的不同表达发现了不少新的萜类化合物。这些萜类合成酶由异戊烯转移酶(PT)和萜类环化酶(TC)组成。PT合成香叶基香叶基焦磷酸酯(GGPP)或香叶基金合欢基焦磷酸酯(GFPP),TC将聚戊烯基转化为环状产物。重要的是,通过基因采掘方法得到的萜类化合物拥有新颖的骨架类型。然而,仅仅使用传统的方法难以确定这些结构复杂的萜类化合物的构型,对于氧化度较低的萜类尤其如此。在此,Abe和Fujita等人报道了astellifadiene (1)的发现及快速结构确定方法。此外,该团队还对化合物1进行了环合反应机理研究。
为了得到新的萜类化合物,研究者采用裸胞壳属Emericella variecolor NBRC 32302作为一个潜在的萜类合成酶基因。该团队之前从真菌里发现了两个新的双官能团合成酶,它们可能是非典型的萜类合成酶基因。在其中,他们选择了一种716个氨基酸构成的蛋白质。根据之前对这类合成酶的官能团结构解析,这种基因异源表达在米曲霉NSAR1中。通过GC-MS分析含有该基因的转化株的菌丝提取物,结果表明,新的代谢物1质荷比为m/z 340 [M]+。由此,他们推测1是一个新的二倍半萜。
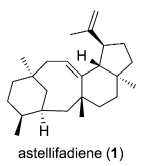
通过HR-MS推知1的分子式为C25H40,则其不饱和度为6。13C NMR显示其25个碳信号中,有4个烯碳原子,表明1具有四环骨架。由1H-1H COSY、HMBC和NOESY相关谱,确定1的平面结构为6/8/6/5的四环新颖骨架结构,其绝对构型的确认则需用到晶体海绵法。
通过X-ray Bijvoet方法,可以直接提供分子手性信息。由于1以油状形式存在,不适合进行普通的衍射研究。然而,在化合物没有晶体结构的情况下,晶体海绵方法可以直接确定化合物的绝对构型,因此,Abe和Fujita及合作者选择这种方法来确定化合物的绝对构型。这是首次应用这种技术来确定烃类化合物的绝对构型。
通过形成一个多孔结构的晶体海绵[(ZnI2)2(tpt)3·x(solvent)]n [tpt =三异丙基乙磺酰(4-吡啶基)-1,3,5-三嗪],运用X-单晶衍射技术,确定了化合物1绝对构型为2S, 3S, 7R, 11R, 14R, 15S, 18S。此外,化合物1的优势构象为:A环和C环为椅式构象,而环B为环辛烯的船-船构象(如下图D标示)。
接下来,研究者采用乙酸钠(1-13C)进行同位素示踪,探究了化合物1的环合机理。真菌的生物合成途径一般为甲羟戊酸途径,来源于乙酸钠(1-13C)的DMAPP和IPP在C1和C3处作了标记,因此,产生带有13C的GFPP在10位碳原子处。二倍半萜1的C-1,C-3,C-5,C-7,C-9,C-11,C-13,C-15,C-17,C-19被标记了同位素。结果表明,这些标记模式并不符合异戊二烯规则,由此证明在生物合成时,碳碳键发生了迁移。基于这些现象,Abe和Fujita团队提出了产生化合物1的环化的可能机理:GFPP消除了OPP后,发生在C-1–C-11和C-10–C-14的环合作用产生了一个11/5环系(2+);然后,随着末端π键的扩环作用和碳键重排形成C-13–C-15和C-14–C-18两个新键,从而形成一个具有11/6/5环系的中间产物3+;异丙基的一个甲基去质子化产生中间物4,至此,完成了反应的前半部分。C-3的质子化作用开启了二次环合作用形成C-2–C-6键,由此形成了5/8/6/5碳正离子5+。5+通过过键的迁移形成6+:一个二环[5.3.1]十一烷骨架。最后,从C-10到C-6的1,5-迁移反应和C-9的去质子化作用,形成了化合物1。在碳正离子6+中,H-10非常接近C-6,这点也支持从C-10到C-6的迁移反应的可能性。
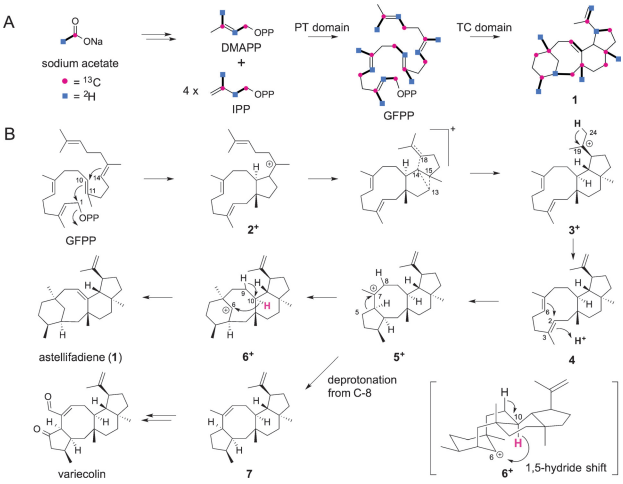
此外,研究者将[1-13C,2H3]乙酸钠或[2-13C,2H3]s乙酸钠加入1中,结果表明,当[1-13C,2H3]加入后,C24标有2H,而不是C25,由此说明初始的去质子化是发生在源自DMAPP的C-5的甲基处。此外,从C-10迁移至C-6的H原子也很重要。而且,实验结果表明,C-9上没有起初标记的氘原子,这一点和他们提出的发生在C-10和C-6之间的1,5-迁移反应是符合的。
为进一步确证环合作用机理,Abe和Fujita等人在体外进行了大肠杆菌中重组EvAS的表达实验。在DMAPP、IPP和Mg2+条件下,合成1后,在重水里发生反应,以此验证4是否发生质子化反应。实验结果发现1中有一个氘原子,说明第二次环合作用是通过质子化反应开始的。
环合反应首先是形成11/5的二元环碳正离子,这和fusicoccadiene、phomopsene、ophiobolin F以及stellatatriene的合成是一样的。这个发现说明了EvAS的TC域和上述提到的那些酶是一样的,都属于B分支。有趣的是,1的绝对构型和variecolin是类似的。考虑到它们结构的相似性,可以预测,化合物7可能和1一样,也是通过形成中间体5+,然后C-8再去质子化而形成。
最后,基于同源模型fusicoccadiene的合成酶PaFS的晶体结构研究结果,证明TS的氨基酸残基包含在凹处的底端活性位点在EvAS中表现独特。在PaFS中由大至小的取代基F65,W225和M309极大地增加了EvAS中活性位点的容积,改变了其形状。这些不同之处或许可以解释萜类环化酶的基质和产出的特异性。

http://onlinelibrary.wiley.com/doi/10.1002/anie.201601448/abstract
(本文由浮生若梦供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号