蛋白质组学研究中新的酶切利器:Lys-C/Arg-C组合
蛋白质组学是在整体水平上研究生物体内所有蛋白质特征的学科,包括蛋白质鉴定、蛋白质翻译后修饰和蛋白质-蛋白质相互作用。近年来,随着质谱技术的发展,蛋白质组学的发展也越来越迅速,已应用到生命科学研究的各个领域中,例如临床肿瘤标志物的研究等。
蛋白质组学主要分为“Bottom-up”、“Middle-down”和“Top-down”三种研究策略。目前最成熟的是“Bottom-up”策略,即先将蛋白质经过蛋白水解酶酶切得到肽段,并使用LC-MS/MS进行分析,之后经过数据库的检索匹配,得到对应肽段的序列信息,从而鉴定相应的蛋白质。其中酶切是不可或缺的一步,其酶切效率和特异性对后续的定性定量研究结果起着关键的作用。
胰蛋白酶(trypsin)是目前“Bottom-up”策略中使用最广泛的蛋白水解酶,能特异性酶切赖氨酸和精氨酸C端的肽键(Lys-X和Arg-X)。它的两个主要优势是:(1)酶切位点特异性高;(2)酶解得到的肽段产物两端各有一个碱性基团,有利于质谱的鉴定。但是由于胰酶在赖氨酸上的酶切效率比较低,因此常常产生不完全酶解的肽段,影响定量结果。蛋白水解酶Lys-C对赖氨酸具有较好的酶切效率,有些研究采用Lys-C/trypsin的组合酶切方式,可以得到更多的完全酶切的肽段,提供更精确的定量信息。但是也有研究表明,Lys-C/trypsin方式导致鉴定数目下降。经过多个课题组的诸多尝试,仍没有发现比trypsin或Lys-C/trypsin更好的酶切方式。
复旦大学研究团队在之前的工作(Anal. Chem., 2018, 90, 1554)中发现,蛋白水解酶Lys-C的错切主要发生在Arg-X上,而蛋白水解酶Arg-C的错切主要发生在Lys-X上,表明Lys-C和Arg-C可能像trypsin一样作用。当采用trypsin的参数进行搜库时,Lys-C和Arg-C酶切的样品鉴定数目都有显著的提高,酶切位点特异性也都比trypsin要高。此外,他们还发现Lys-C在Lys-X位点和Arg-C在Arg-X位点上的酶切效率都强于trypsin。这些结果都证实Lys-C和Arg-C具有类似trypsin的酶切性能,进一步也提示两种酶的组合使用可能会产生比trypsin更好的酶切效果。
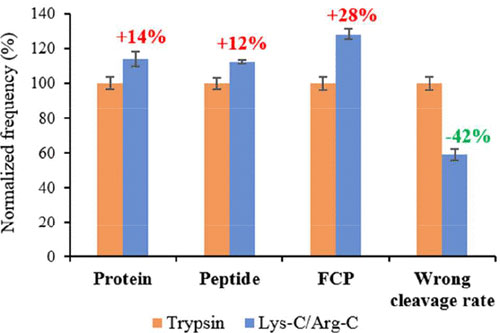
接着,作者对Lys-C/Arg-C组合酶切,与最常用的trypsin以及Lys-C/trypsin组合,进行鉴定能力、消化效率以及酶切位点特异性等方面的比较,发现Lys-C/Arg-C的组合比其它两种方式较好。在对酶切效率的分析上,作者发现在trypsin很难水解的肽键上,如Lys/Arg-Pro/Asp/Glu等,Lys-C/Arg-C具有更好的酶切能力。此外,DIA定量分析也进一步表明Lys-C/Arg-C具有更高的酶切效率,完全酶切的肽段的信号强度更高。
综合上述分析,比起目前广泛使用的trypsin和Lys-C/trypsin,Lys-C/Arg-C组合具有更高的酶切效率和酶切特异性。这种组合酶切具备替代目前最广泛使用的trypsin的潜力,为蛋白质组学的酶解工具箱提供了新的分析利器。该工作发表在Analytical Chemistry上。
该论文作者为:Zhen Wu, Jichang Huang, Jingnan Huang, Qingqing Li and Xumin Zhang
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Lys-C/Arg-C, a More Specific and Efficient Digestion Approach for Proteomics Studies
Anal. Chem., 2018, 90, 9700, DOI: 10.1021/acs.analchem.8b02448
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号