UIUC陆艺团队Science:人工合成金属酶催化还原亚硫酸盐——金属蛋白工程用于催化剂设计的里程碑
无机氧化态阴离子如高氯酸盐、硝酸盐、砷酸盐是环境中的水溶性污染物,它们容易在水域中扩散,导致多种健康或环境问题。现有除去这些氧化态阴离子的方法主要是将单一的氧化态阴离子富集于含金属的有机物中,或用过渡金属元素催化还原。然而这些氧化态阴离子污染物与过渡金属的结合能力弱,而且环境中其他的氧化态离子(如亚硫酸盐)会干扰这些有害氧化态阴离子的生物降解过程,导致氧化态阴离子污染物难以被有效清除。因此,如何去除环境中的氧化态阴离子污染一直是化学家面临的重要挑战。
由于反应步骤多、催化活性位点复杂等原因,设计人工催化剂还原亚硫酸盐的反应在此之前一直没能被科学家实现。这些氧化态离子的还原只能通过微生物膜的无氧呼吸过程完成,该过程中催化这一生物还原反应的是亚硫酸盐还原酶(sulfite reductase, SiR),这种酶包含一个原血红素(Siroheme)和一个立方烷型四铁四硫簇合物([4Fe-4S])。亚硫酸盐还原酶中的一个半胱氨酸残基同时充当原血红素和铁硫簇基团中一个铁原子的配体,帮助电子从铁硫簇转移到原血红素,进行亚硫酸盐的还原反应(图1)。据此原理,此前科学家们试图用同时包含铁硫簇和血红素(heme)的人工合成蛋白结构来模拟亚硫酸盐还原酶,然而这些合成系统没有帮助电子传递的氨基酸残基,并不具备催化还原亚硫酸盐的能力。
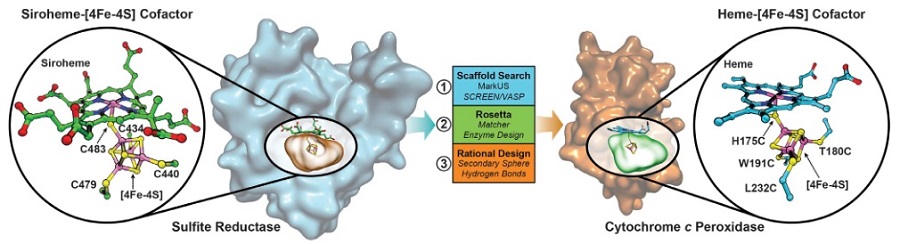
图1. 模拟SiR酶设计细胞色素C过氧化物酶结合铁硫簇位点。图片来源:Science
美国伊利诺伊大学香槟分校(UIUC)的陆艺(Yi Lu)教授课题组长期以来关注于生物合成化学研究以及应用。该课题组使用生物工程及合成生物学方法合成金属蛋白的模拟物作为生物催化剂,并且研究金属蛋白及生物催化剂的结构与功能。此外,该课题组同时关注生物催化剂的小分子激活方式及在再生能源中的应用。最近,该课题组通过将铁硫簇基团引入细胞色素C过氧化物酶(cytochrome c peroxidase, CcP),改造金属和底物结合位点的二级配位区域氨基酸,设计和合成了可还原亚硫酸盐的人工合成金属酶,突破了生物催化领域多年的技术瓶颈。相关论文近期发表在Science 上,同期Science 杂志还刊登了康奈尔大学Kyle M. Lancaster教授对此项工作题为“Revving up an artificial metalloenzyme”的评论文章,称这一成果为“使用金属蛋白工程作为催化剂设计工具的一个里程碑”[1]。

陆艺教授。图片来源:陆艺教授课题组 / UIUC
细胞色素C过氧化物酶是一个天然的血红素结合蛋白,具有体积小、稳定性好的优势。作者利用蛋白设计软件,结合计算分析方法和合理设计原理,筛选针对细胞色素C过氧化物酶蛋白骨架的定点突变,将铁硫簇[4Fe-4S]重组到血红素近端的空腔中。他们选择将第175位的组氨酸突变为半胱氨酸,充当连接血红素和铁硫簇的配体;将第180位的苏氨酸、第191位的色氨酸和第232位的亮氨酸分别突变为三个半胱氨酸,辅助铁硫簇中铁原子;同时将第230位的甲硫氨酸突变为丙氨酸、第235位天冬氨酸突变为缬氨酸以增强蛋白稳定性(图1)。基于这些设计,作者人工合成了基于细胞色素C过氧化物酶蛋白骨架的合成蛋白来模拟天然亚硫酸盐还原酶。
通过一系列的紫外-可见吸收、电子顺磁共振、扩展X-射线吸收精细结构等光谱表征手段,作者证明了细胞色素C过氧化物酶蛋白骨架的表达纯化以及铁硫簇和血红素的成功整合(图2a-c)。接下来,作者分别测试比较了合成蛋白、天然亚硫酸盐还原酶和细胞色素C过氧化物酶与氰根离子的结合能力(图2c-d),并通过比较这三个蛋白存在时亚硫酸钠对电子传递介质甲基紫精的氧化能力,证实人工合成蛋白获得了催化还原亚硫酸盐的能力。
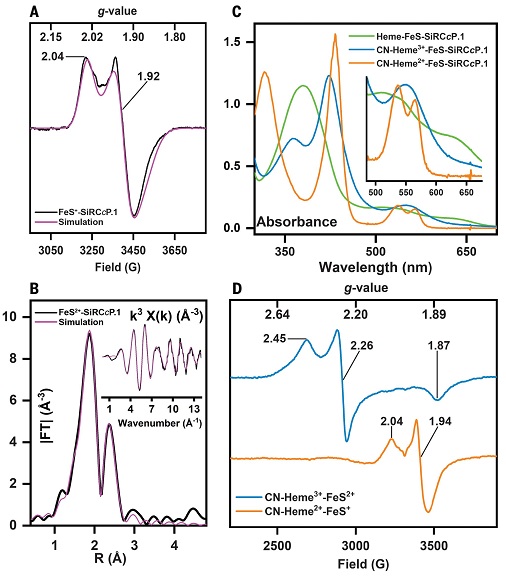
图2. 人工合成蛋白结合血红素及铁硫簇后的光谱性质。图片来源:Science
为进一步提升合成蛋白还原亚硫酸盐的催化能力,作者系统分析了天然亚硫酸盐还原酶的活性区域,并对合成蛋白进行改造,将第51位色氨酸突变为赖氨酸、第52位组氨酸突变为精氨酸、第145位脯氨酸突变为赖氨酸,提升蛋白的底物结合能力和质子化能力,成功将合成蛋白的催化活性提高5.3倍(图3a)。之后作者进一步对合成蛋白中与铁硫簇及血红素相互作用的二级配位区域氨基酸进行优化,将第235位天冬氨酸突变为半胱氨酸(图3b),增加二级配位区域与铁硫簇基团的氢键结合,使合成酶活性较最初版本提高63倍。经过连续的改造,合成蛋白的活性达到天然亚硫酸盐还原酶的近20%(图3c),能将亚硫酸盐还原为硫化氢(六电子还原产物)以及两电子和四电子还原的中间产物。总体电子利用率高达90%,底物转化效率接近异化型的天然亚硫酸盐还原酶。整个合成蛋白的改造过程揭示了二级配位区域氨基酸对多电子转移的氧化还原反应酶活性具有重要作用,为其他利用简单蛋白骨架实现多电子、多质子转移反应的蛋白工程学研究提供启发和借鉴。
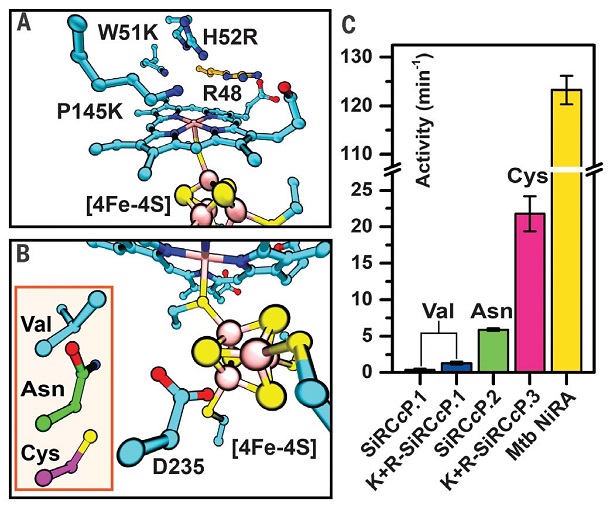
图3. 结合铁硫簇的二级配位区域氨基酸残基突变决定人工合成蛋白催化活性。图片来源:Science
——总结——
作为环境的主要污染物,不同氧化态的酸根离子如何清除降解一直是困扰化学家和生物化学家的瓶颈问题。如今,陆艺教授课题组通过模拟生物体中的亚硫酸盐还原酶,基于简单的蛋白骨架,针对性地设计并成功合成能催化多电子转移反应的高效率新型催化剂,为设计更多的酶类提供了新思路,也在环境污染治理等相关领域有重要意义。该研究主要得到美国国立卫生研究院和美国能源部的重要资助。陆艺教授课题组在该研究及相关研究中获得多项国际专利,并积极推动科研成果的市场转化。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A designed heme-[4Fe-4S] metalloenzyme catalyzes sulfite reduction like the native enzyme
Science, 2018, 361, 1098-1101, DOI: 10.1126/science.aat8474
参考资料:
1. Revving up an artificial metalloenzyme. Science, 2018, 361, 1071-1072, DOI: 10.1126/science.aau7754
研究团队简介
陆艺教授现为美国伊利诺伊大学香槟分校化学系、生物化学系、材料科学及工程系、生物工程系终身教授,HHMI教授,并在伊利诺伊大学Beckman研究所、生物物理及定量生物学研究所、生物基因组学研究所生物系统设计方向、纳米技术及精准药物方向任职。他的研究领域集中在生物合成无机化学及催化蛋白的机制以及应用,包括金属蛋白催化剂模拟、信息化预测蛋白活性、多种蛋白质的氧化还原电势调节、电子传递蛋白改造、氮氧化物还原酶应用等。他的研究工作得到了美国国立卫生研究院、美国自然科学基金、能源部资助,在Nature、Science、JACS、PNAS、Nature Chemistry、Nature Nanotechnology 等期刊发表论文330余篇,获得专利30个,论文引用超过20,000次。他获得多项科研及教学奖项,包括英国皇家化学学会应用无机化学奖、英国皇家化学会会员、美国科学促进协会会员、Jay and Ann Schenck教授、优秀教学奖等。从2015到2017年,陆教授连续三年被汤森路透列入“高被引用科学家”名单。
陆艺教授
https://chemistry.illinois.edu/yi-lu
http://www.x-mol.com/university/faculty/188
课题组主页
http://lulab.scs.illinois.edu/
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号