天然产物(+)-Stephadiamine的首次全合成
有机合成化学家几十年来一直在寻找合成吗啡与哈苏班纳生物碱的高效方法。Marshall Gates等人于1952年首次报道了吗啡(1)的合成,随后化学家陆续发表了三十多篇相关的合成论文。哈苏班纳生物碱Hasubanonine(2)于1951年由Konto等人完成首次分离,随后人们也报道了很多该分子的合成方法。然而,该系列分子中Stephadiamine(3)的合成却并未得到人们的重视,这种天然产物由Taga等人于1984年首次完成分离。Stephadiamine的绝对构型可通过其苯甲酰化产物的X射线单晶衍射得以确定。从结构上看,Stephadiamine拥有五环骨架,同时包含氮杂[4.3.3]螺桨烷结构,含有四个手性中心,包括一个苄位的季碳中心、两个相邻的顺式三级胺手性中心和一个苄位含氧的季碳手性中心。
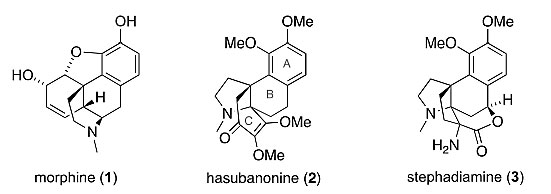
与Stephadiamine相关的天然产物。图片来源:J. Am. Chem. Soc.
最近,德国慕尼黑大学的Dirk Trauner教授及其团队通过高效的串联过程构建了氮杂[4.3.3]螺桨烷核心骨架结构,由此首次完成了天然产物(+)-Stephadiamine的全合成。他们还通过关键Tollens反应和Curtius重排反应构建了空间位阻较大的α-氨基内酯。相关工作发表在J. Am. Chem. Soc. 上。
作者对Stephadiamine进行了逆合成分析。起初的策略是在后期修饰阶段通过化合物4的分子内双胺化反应同时构建相邻的顺式三级胺和氮杂[4.3.3]螺桨烷骨架。含有二胺和环戊烯羧酸酯结构的化合物4可通过α,β-不饱和酯5的还原Aldol缩合反应制备。5可由已知化合物萘满酮6合成,6又可由商品化的羧酸7合成。
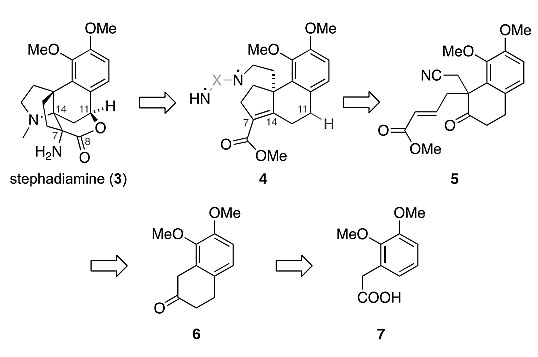
Stephadiamine逆合成分析。图片来源:J. Am. Chem. Soc.
商品化的羧酸7首先转化成酰氯,接着在AlCl3的催化下与乙烯发生环化,以两步48%的总产率得到萘满酮6。6接着在Stork反应的条件下与溴代乙腈进行烷基化反应,得到的中间体接着与氯甲酸烯丙酯反应,再进行脱羧Tsuji烯丙基化反应,以三步73%的总收率得到萘满酮8,8接着与丙烯酸甲酯进行烯烃复分解反应,以97%的产率得到中间体5。顺利得到5以后,作者紧接着探究还原Aldol反应构建五元环的过程,使用Stryker试剂时,作者仅仅得到中间体5双键的还原产物,同时生成内酯9和微量预期的Aldol产物10。作者还尝试了一些其他的氢源如L-Selectride等,然而只会增加内酯9的生成。
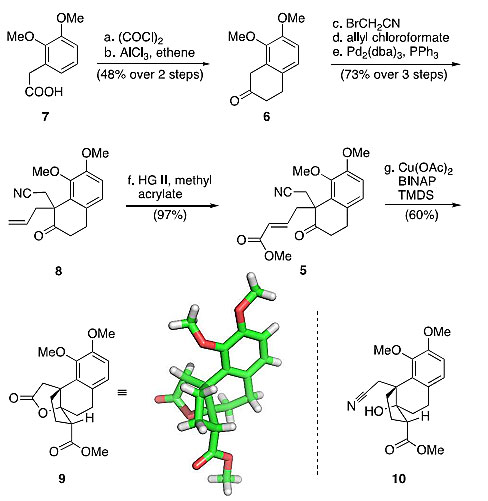
萘满酮8的合成和Aldol缩合反应的尝试。图片来源:J. Am. Chem. Soc.
为了得到含有腈类结构的中间体10,作者尝试先对5进行氢化,得到中间体11,再与原位生成的甲醇钠反应,以非常优秀的合并产率分离出两种新的产物。令人惊讶的是,这两种产物分别是吡咯烷酮16和相应的C-7差相异构体17,两种化合物都含有3的氮杂[4.3.3]螺桨烷核心骨架。饱和酯11在甲醇钠的作用下得到烯醇酯12,接着进行分子内的Aldol反应得到烷氧化物13,13中的氧负离子随后亲核进攻腈,再发生消除反应得到中间体15。15接着再进行分子内的氮杂Michael加成反应,得到吡咯烷酮16和相应的C-7差相异构体17。
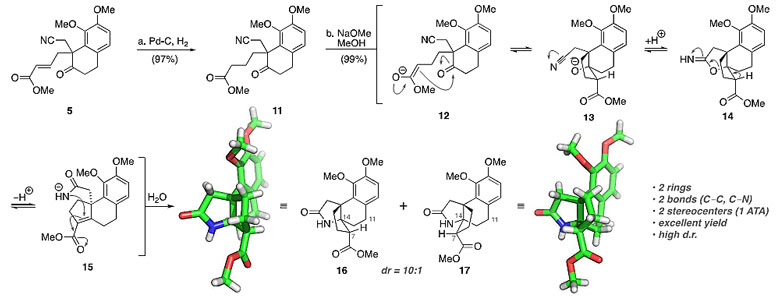
串联反应构建氮杂[4.3.3]螺桨烷核心骨架。图片来源:J. Am. Chem. Soc.
他们尝试对16和17去质子化并与各种亲电胺化试剂反应,然而要么得到难以鉴定的化合物,要么原料未发生反应。作者还尝试了其他的方法来引入第二个氨基,但都没有成功。作者猜测化合物16和17在去质子化这一步可能出现了问题。为了提高两种化合物中α-H的酸性,作者将其中的酯还原为醛18,并在过量氢氧化钾的存在下与甲醛反应,得到二醇化合物19,接着在DDQ的氧化条件下顺利环化得到中间体20。20接着进行Ley氧化/Pinnick氧化/Curtius重排三步反应,以75%的总收率得到化合物21。顺利得到21后,他们只需要氧化四氢吡喃形成内酯,并发生胺的保护基消除,就可完成3的合成工作。作者意识到,由于分子中存在苄位C-H键以及富电子的芳香环,氧化反应非常具有挑战性。作者尝试筛选了RuO4、KMnO4、CrO3、DMDO等氧化剂,却没有得到任何氧化产物。经过一系列失败的氧化反应后,作者果断放弃了氧化的策略,转而先断裂C11–O键并氧化C8位形成羧酸,接着进行杂环的重新环化。化合物21在PtO2/H2、Pd-C/H2、TFA/Et3SiH和AcOH/Et3SiH的条件下都不能有效断裂C-O键。作者接着将目光转向研究将苄醚转化为烯烃的不同条件,最终使用BF3•OEt2和醋酸酐可有效将21转化为烯烃中间体22,22接着与Boc2O反应,再发生水解得到中间体23。23再经过Ley氧化得到中间体24,接着进行碘参与的氧化反应得到25。作者尝试多种其他的氧化条件都得到类似的氧化结果,然而在碘/甲醇体系下可以高产率地得到酯中间体26。
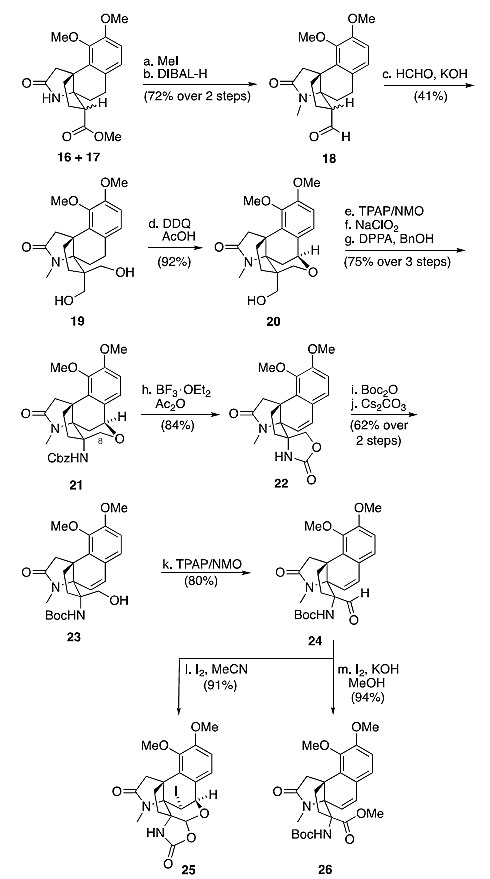
二胺的构建。图片来源:J. Am. Chem. Soc.
由于酯26很难水解,因此作者直接将其在NBS的条件下环化得到化合物28,28通过自由基反应脱溴得到29,29的构型通过X射线单晶衍射得以确定。化合物29再通过硼烷还原酰胺和消除Boc保护基两步反应,最终完成3的合成工作。
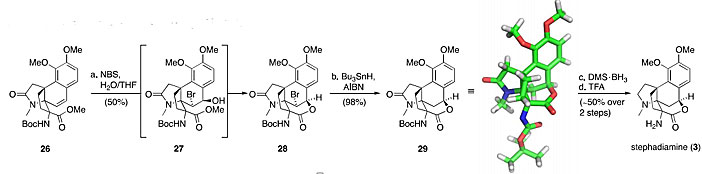
(+)-Stephadiamine的最终合成。图片来源:J. Am. Chem. Soc.
作者在进行消旋Stephadiamine合成的同时,也对手性合成过程进行了探索。他们从烯丙基碳酸酯31出发,尝试合成手性化合物(S)-8,通过钯催化的Tsuji不对称脱羧烯丙基化反应,筛选了包括配体在内的诸多反应条件,但是反应结果不是很理想,对映选择性最高只有66%。
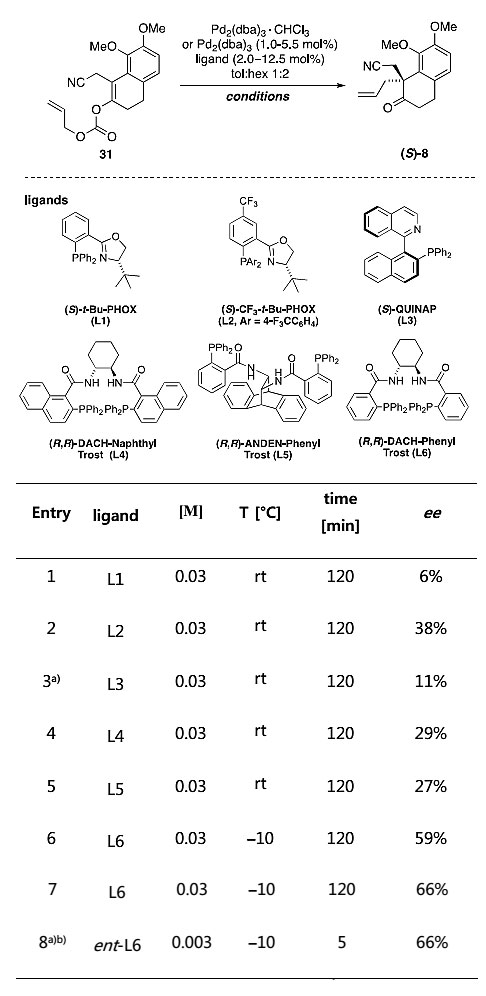
手性化合物(S)-8合成条件的筛选。图片来源:J. Am. Chem. Soc.
受到List等人工作的影响,作者在探索优化化合物8的对映选择性时,尝试了非对称酮的直接官能化反应。他们对底物32进行了一系列的条件优化,最终权衡产率和对映选择性,催化剂B脱颖而出,最佳的反应浓度是0.01 M,最佳的温度是15 ℃,在该条件下,反应以63%的产率和93%的对映选择性得到产物8。
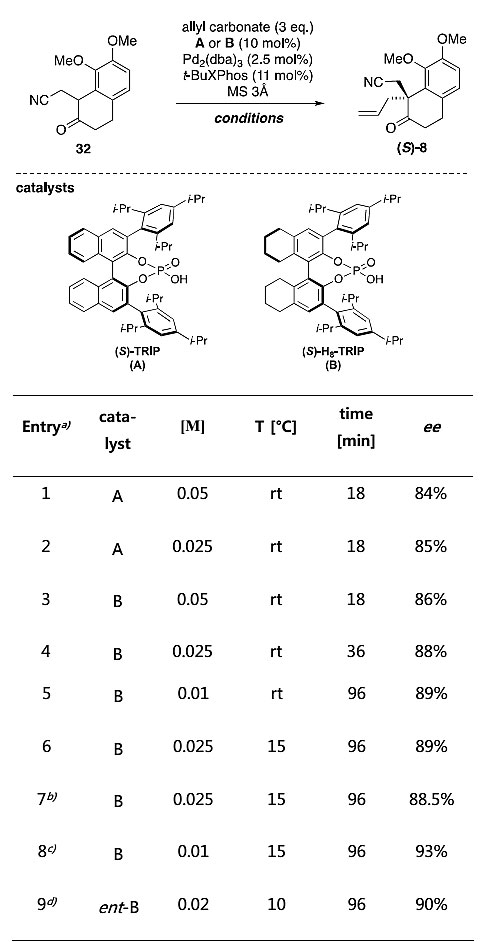
手性化合物(S)-8合成条件的筛选。图片来源:J. Am. Chem. Soc.
总结
Dirk Trauner教授及其团队首次报道了Stephadiamine的全合成工作,整个合成过程就像一个故事一般跌宕起伏。此外,作者通过细致的条件筛选完成了关键中间体的催化不对称合成,为Stephadiamine及其类生物碱的手性合成奠定了坚实的基础。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文)

Total Synthesis of the Norhasubanan Alkaloid Stephadiamine
J. Am. Chem. Soc., 2018, DOI: 10.1021/jacs.8b01918
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号