小改变,大不同:轴向单边酯化的顺铂前药抗肿瘤效果显著
作为新一代的铂类抗肿瘤药物,四价铂前药近年来引起国内外科研工作者的广泛关注。四价铂具有八面体的空间配位结构,既增强了配合物的惰性,降低其在体内输送过程中的毒副作用,又为配合物的结构修饰提供了便利。当四价铂前药进入癌细胞后,基于癌细胞内的还原性环境,四价铂将还原,释放出活性二价铂单元(例如顺铂)和轴向配体。二价铂与DNA结合,造成DNA损伤;轴向配体发挥自身的生物活性,从而与Pt(II)合力杀死癌细胞。四价铂前药的兴起为降低铂类药物的毒副作用、实现口服、克服顺铂耐药性等提供了新的思路。
香港城市大学的朱光宇(点击查看介绍)课题组一直致力于具有抗肿瘤活性铂类配合物的功能化修饰和机理研究。基于Pt对DNA的损伤及其相关通路,该课题组先后报道了chalcoplatin和NERi-Pt(IV)两种四价铂前药(图1)。Chalcoplatin以MDM2的拮抗剂查尔酮(chalcone)为轴向配体,进入细胞还原后将释放出Pt(II)和查尔酮。一方面,Pt(II)损伤DNA;与此同时,查尔酮将打破MDM2与p53蛋白的结合,使肿瘤抑制蛋白p53恢复功能。检测到DNA损伤后,“复活的”p53蛋白将造成细胞周期阻滞,“判断”DNA损伤能否有效修复;如无法修复,p53将启动细胞的程序性死亡,即凋亡。Chalcoplatin通过顺铂与查尔酮的偶联,提高了p53蛋白的表达量,在p53野生型癌细胞中活性优于顺铂,并有效克服了顺铂的耐药性。NERi-Pt(IV)将核苷酸剪切修复的抑制剂(Nucleotide Excision Repair Inhibitor,NERi)引入轴向,通过细胞内的还原释放Pt(II)和NERi。实验结果证实,NERi显著抑制了受损伤DNA的修复,从而使癌细胞启动凋亡机制而死亡。与顺铂相比,NERi-Pt(IV)对耐药细胞株的细胞毒性显著提高。

图1. Cisplatin(顺铂)、NERi-Pt(IV)、chalcoplatin和monochalcoplatin的结构式
近日,朱光宇课题组报道了chalcoplatin的类似物——含有查尔酮的单边酯化四价铂前药monochalcoplatin,虽然其与chalcoplatin的区别只在于是否保留一侧轴向的OH基团,但是两者的生物活性和作用机理却大不相同。在所测试的肿瘤细胞株中,monochalcoplatin的IC50值均处于纳摩尔级别,细胞毒性远远高于顺铂和chalcoplatin。例如,在A2780细胞中,monochalcoplatin的IC50值仅为10 nM。值得一提的是,monochalcoplatin能够有效地克服顺铂的耐药性。在顺铂耐药型细胞株A2780cisR和A549cisR中,monochalcoplatin的IC50值分别为70 nM和140 nM。而在HCT116细胞中,monochalcoplatin的细胞毒性相当于顺铂的422倍。在小鼠活体实验中,monochalcoplatin的效果优于顺铂,非常有效地抑制了HCT116肿瘤的生长(图2)。Monochalcoplatin是目前为止活性最好的四价铂前药之一。
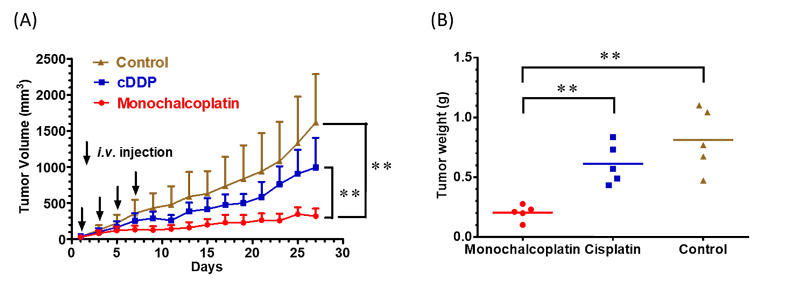
图2. 小鼠体内的抗肿瘤活性:(A)肿瘤体积的变化;(B)肿瘤重量的比较。Control: solvent only, cDDP: 0.95 mg•Pt/kg, monochalcoplatin: 0.72 mg•Pt/kg。图片来源:Angew. Chem. Int. Ed.
药物作用机理研究表明,monochalcoplatin能够在6 h内引起细胞凋亡,但是并没有上调p53蛋白的表达量;monochalcoplatin能够在1 h内与细胞内的DNA结合,在较短的时间内(4 h)造成DNA双链断裂(DSBs)。有趣的是,虽然monochalcoplatin与chalcoplatin氧化还原电势相近,但是在NaAs存在的条件下,前者能够迅速还原,而后者不能,与细胞内DNA结合的实验结果一致(图3)。
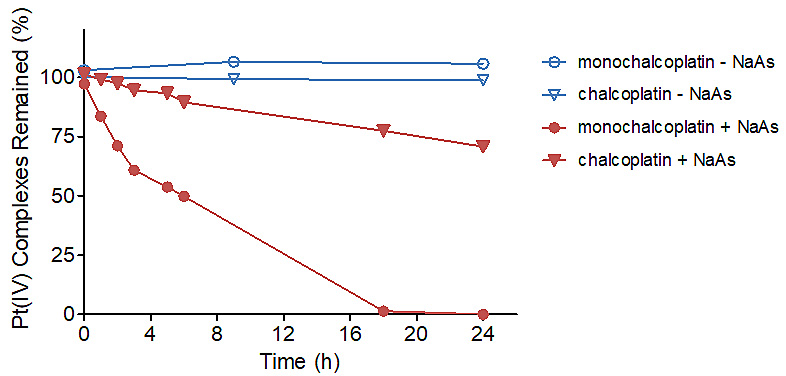
图3. Monochalcoplatin和chalcoplatin在NaAs作用下发生还原(RP-HPLC)。50 mM Pt(IV) ± 2 mM NaAs。图片来源:Angew. Chem. Int. Ed.
为了探究monochalcoplatin高抗肿瘤活性的原因,作者对前药的细胞摄取进行了细致的研究。实验表明,monochalcoplatin具有远高于顺铂和chalcoplatin的细胞摄取量,由此可能成为其高活性的重要原因之一。作者测试了不同条件下monochalcoplatin的细胞摄取量,结果表明,monochalcoplatin进入细胞的主要方式是主动运输,并非被动扩散或者细胞内吞/大胞饮(图4)。此外,为了证实查尔酮配体是否在前药的细胞摄取方式上起到主要作用,作者设计合成了基于奥沙利铂的含查尔酮的单边、双边酯化四价铂前药,但是两者的细胞毒性和细胞摄取量相近,并且都远低于monochalcoplatin,表明monochalcoplatin的细胞摄取方式由分子的整体结构决定,并非单纯依赖于查尔酮配体。
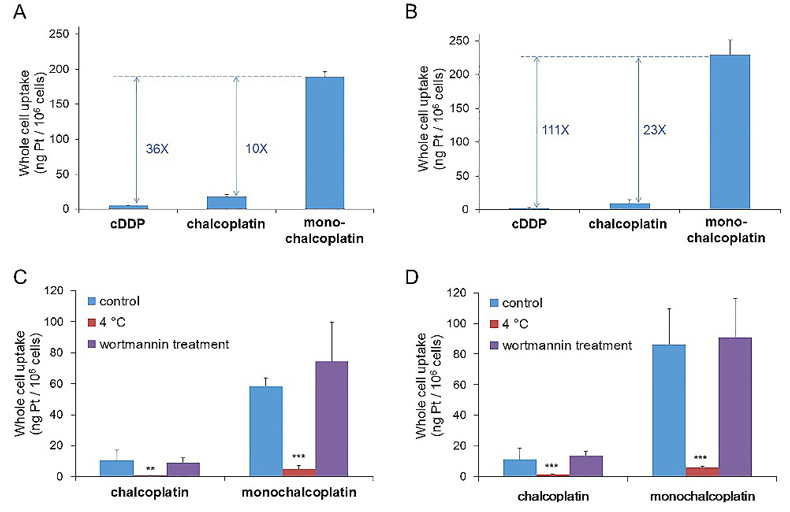
图4. Monochalcoplatin的细胞摄取。(A) A2780 cells, 10 μM Pt complexes for 6 h; (B) A2780cisR cells, 10 μM Pt complexes for 6 h; (C) A2780 cells, 10 μM Pt complexes for 1 h; (D) A2780cisR cells, 10 μM Pt complexes for 1 h。图片来源:Angew. Chem. Int. Ed.
该工作介绍的monochalcoplatin以主动运输的方式进入细胞,并具有高活性,能够快速还原,通过不依赖于p53的途径引起细胞凋亡(图5),为设计合成利用细胞膜表面的转运蛋白,从而以主动运输的方式大量摄取四价铂前药提供了借鉴;结构上的小变化,可能会导致完全不同的生物活性及作用机理;同时,引入的配体不一定达到预期的生物活性。
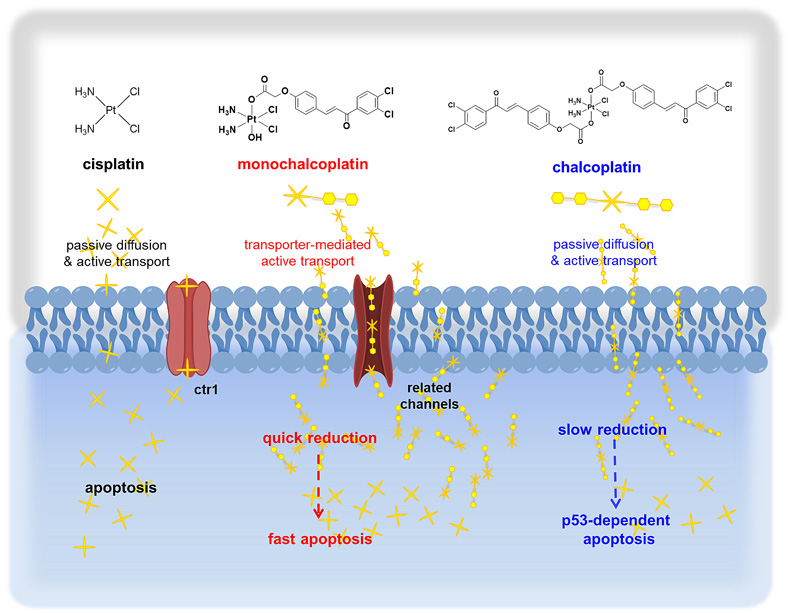
图5. Monochalcoplatin作用机理的示意图。图片来源:Angew. Chem. Int. Ed.
这一成果发表在Angewandte Chemie International Edition 上,文章的第一作者为香港城市大学化学系的博士毕业生马丽丽博士。
该论文作者为:Lili Ma, Na Wang, Rong Ma, Cai Li, Zoufeng Xu, Man-Kit Tse and Guangyu Zhu
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Monochalcoplatin: An Actively Transported, Quickly Reducible, and Highly Potent PtIV Anticancer Prodrug
Angew. Chem. Int. Ed., 2018, DOI: 10.1002/anie.201804314
导师介绍
朱光宇
http://www.x-mol.com/university/faculty/26823
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号