CO前药的开发及结构优化
长期以来,一氧化碳(CO)公认为是“无声的杀手”(silent killer),该气体能与血红蛋白结构中的血红素(heme)结合,且亲和力是氧气的200倍,从而阻断血红蛋白的供氧功能。而在过去二三十年的时间里,CO已经证实是体内非常重要的气体信使小分子之一。如同NO和H2S一样,CO在哺乳动物体内发挥着重要的生理调节作用。此外,越来越多的研究表明,CO对多数疾病都具有明显的治疗作用,其中包括抗细菌/病毒、抗肿瘤、抗炎以及显著提高器官移植中受体的存活率等。这些发现都使CO具有广阔的临床应用前景。一期临床试验已经证实,短时间低浓度(500 ppm, 1 h)的CO对人体并没有明显的毒副作用。此外,相比于其他营养素及体内信使分子(如胰岛素),CO具有更宽的治疗窗口。目前利用CO气体治疗肺动脉高血压的研究已进入临床试验阶段,尽管如此,以气体作为临床输送CO的方式存在很多缺陷:以吸入形式的给药只能在医院才能进行,病人携带较为不便;CO气体剂量很难控制,且给药方式严重依赖病人是否具有健全的肺部功能;CO气体释放不可控,由此带来的脱靶效应也不容小觑。因此,研发片剂形式的CO前药是开发CO作为药物临床应用急需解决的一个关键问题。
但CO前药的设计是一项极具挑战性的工作。首先,CO作为气体小分子没有合适的基团可供化学衍生;其次,CO本身是一种非常惰性的气体,主要参与和过渡金属的配位形成金属络合物。迄今为止,大部分的CO供体(CO releasing molecules,简称CO-RMs)都是基于不同过渡金属的CO络合物。显然,重金属的存在使这类CORMs的临床应用存在很多阻力,理想的解决办法是应用有机小分子前药。佐治亚州立大学化学系的王炳和教授(点击查看介绍)课题组曾报道利用click化学制备了首个有机小分子CO前药(点击阅读详细)。为了进一步改善CO的释放机理,该课题组近期研发了一系列基于不同释放机理的有机小分子CO前药,包括酯水解酶、pH及ROS激活的CO前药。
1. 酯水解酶激活的CO前药

图1. 酶催化激活有机小分子CO前药
王教授课题组的季兴跃博士利用构象限制的策略,即通过一个七元环限制炔的构象,使其不能靠近环戊二烯酮发生click反应,当七元环中的-Y-X-链接子被酶或者其他内源性刺激药物切断后,炔可自由旋转而与环戊二烯酮发生click反应,进而释放CO(图1),由此实现CO的可控释放。实验结果也证实该设计的有效性,在没有酶存在的情况下,化合物1会缓慢水解释放CO,但半衰期长达17 h,而在酯水解酶存在的条件下,半衰期缩短到1 h。该过程始终没有监测到化合物4的生成,表明七元环确实能限制炔基的构象来阻止click反应。随后的生物实验表明,化合物1能被细胞内的酯水解酶激活释放CO,并能有效抑制LPS诱发的TNF-α水平升高。可以预见,变换不同的-Y-X-链接子后,该策略可用于设计其他内源性刺激激活的CO前药,为实现CO的靶向输送打下坚实的基础。以上研究成果发表在Chemical Communications(Chem. Commun., 2017, 53, 8296)上。季兴跃博士是文章的第一作者,王炳和教授是文章的通讯作者。
2. 基于pH敏感的CO前药设计
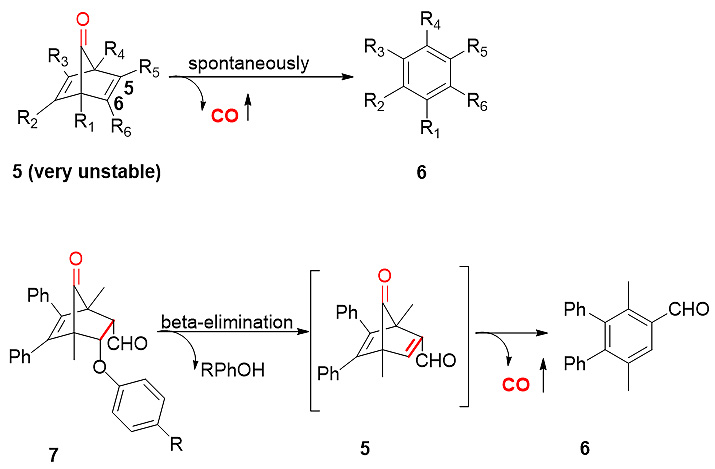
图2. pH敏感的CO前药
王教授课题组利用化合物5和7之间的稳定性差异,设计了一系列pH敏感的有机小分子CO前药。化合物5是炔和环戊二烯酮反应的中间体,极不稳定,能瞬间释放CO。有趣的是,化合物5的衍生物7(C5、C6位为单键)却异常稳定,只有在高温(180 ℃)才释放CO。因此,王教授课题组的季兴跃博士在化合物7的C5、C6位分别修饰吸电子基团(-CHO)和离去基团(RPhO-),利用β-消除反应在生理环境下形成中间体5并释放CO。该类CO前药对所处环境的pH值非常敏感,在酸性条件下(胃酸模拟液),化合物7的半衰期长达9 h以上,而在pH为7左右时,半衰期只有0.5 h左右。此外,化合物7释放CO的速率与取代基R的Hammett常数呈现出非常好的线性关系,可用于定量预测新CO前药的释放速率。该类CO前药也在细胞水平上重现了CO的抗炎活性。可以预见,利用消化道pH的变化,该类CO前药可用于靶向下消化道的CO输送,用于治疗炎症性肠病。以上研究成果发表在Chemical Communications(Chem. Commun., 2017, 53, 9628)上,季兴跃博士是文章的第一作者,王炳和教授是文章通讯作者。
3. ROS激活的CO前药

图3. ROS敏感的CO前药
王教授课题组同样利用化合物8与10的稳定性差异,研发出一类由ROS激活的CO前药。如图3所示,化合物8的C5、C6位为单键,且在C6位没有吸电子基团,因此8是非常稳定的化合物,在大多数情况下并不会释放CO。在ROS(如ClO-)存在的情况下,化合物8会氧化为9,发生selenoxide消除反应而得到不稳定的中间体10,10在生理条件下会瞬间释放CO。实验结果表明,化合物8在PBS中孵育24 h后也没有检测到CO的释放,而在加入ClO- (40 uM)后,化合物8很快转变为11并释放CO(t1/2 < 1 min)。化合物8还实现了靶向炎症细胞和肿瘤细胞(这两种细胞都具有高表达的ROS水平)的输送,而在正常的心肌细胞不释放CO。此外,化合物8还能增加肿瘤细胞对抗肿瘤药物多柔吡星的药敏性,而对正常细胞没有相似的效果。上述研究结果发表在Organic Letters(Org. Lett., 2018, 20, 8)上。文章的第一作者是佐治亚州立大学的博士生潘志祥,通讯作者是季兴跃博士和王炳和教授。
目前,王教授课题组正在对这几类CO前药做进一步的结构优化,以增加目标化合物的成药性,从而为CO推向最终的临床应用打下坚实的基础。
导师介绍
王炳和
http://www.x-mol.com/university/faculty/5237
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号