当前位置:
X-MOL 学术
›
ACS Chem. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Characterization of Three Druggable Hot-Spots in the Aurora-A/TPX2 Interaction Using Biochemical, Biophysical, and Fragment-Based Approaches
ACS Chemical Biology ( IF 4 ) Pub Date : 2017-10-30 00:00:00 , DOI: 10.1021/acschembio.7b00537 Patrick J. McIntyre 1 , Patrick M. Collins 2 , Lukáš Vrzal 3, 4 , Kristian Birchall 5 , Laurence H. Arnold 5 , Chido Mpamhanga 5 , Peter J. Coombs 5 , Selena G. Burgess 6 , Mark W. Richards 6 , Anja Winter 1 , Václav Veverka 4 , Frank von Delft 2, 7, 8 , Andy Merritt 5 , Richard Bayliss 6
ACS Chemical Biology ( IF 4 ) Pub Date : 2017-10-30 00:00:00 , DOI: 10.1021/acschembio.7b00537 Patrick J. McIntyre 1 , Patrick M. Collins 2 , Lukáš Vrzal 3, 4 , Kristian Birchall 5 , Laurence H. Arnold 5 , Chido Mpamhanga 5 , Peter J. Coombs 5 , Selena G. Burgess 6 , Mark W. Richards 6 , Anja Winter 1 , Václav Veverka 4 , Frank von Delft 2, 7, 8 , Andy Merritt 5 , Richard Bayliss 6
Affiliation
|
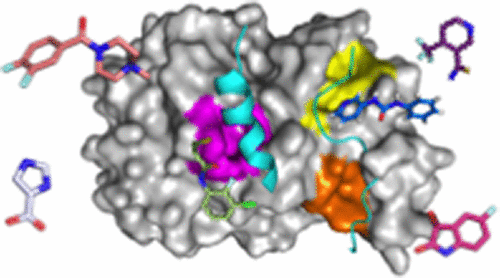
The mitotic kinase Aurora-A and its partner protein TPX2 (Targeting Protein for Xenopus kinesin-like protein 2) are overexpressed in cancers, and it has been proposed that they work together as an oncogenic holoenzyme. TPX2 is responsible for activating Aurora-A during mitosis, ensuring proper cell division. Disruption of the interface with TPX2 is therefore a potential target for novel anticancer drugs that exploit the increased sensitivity of cancer cells to mitotic stress. Here, we investigate the interface using coprecipitation assays and isothermal titration calorimetry to quantify the energetic contribution of individual residues of TPX2. Residues Tyr8, Tyr10, Phe16, and Trp34 of TPX2 are shown to be crucial for robust complex formation, suggesting that the interaction could be abrogated through blocking any of the three pockets on Aurora-A that complement these residues. Phosphorylation of Aurora-A on Thr288 is also necessary for high-affinity binding, and here we identify arginine residues that communicate the phosphorylation of Thr288 to the TPX2 binding site. With these findings in mind, we conducted a high-throughput X-ray crystallography-based screen of 1255 fragments against Aurora-A and identified 59 hits. Over three-quarters of these hits bound to the pockets described above, both validating our identification of hotspots and demonstrating the druggability of this protein–protein interaction. Our study exemplifies the potential of high-throughput crystallography facilities such as XChem to aid drug discovery. These results will accelerate the development of chemical inhibitors of the Aurora-A/TPX2 interaction.
中文翻译:

使用生化,生物物理和基于片段的方法表征Aurora-A / TPX2相互作用中的三个可药用热点
有丝分裂激酶的Aurora-A及其伙伴蛋白TPX2(Ť argeting P rotein为X enopus驱动蛋白样蛋白2)在癌症中过表达,并且有人提出它们可以作为致癌全酶共同发挥作用。TPX2负责在有丝分裂期间激活Aurora-A,确保适当的细胞分裂。因此,与TPX2的界面破坏是新型抗癌药物的潜在目标,这些新型抗癌药物利用了癌细胞对有丝分裂应激的增强敏感性。在这里,我们研究使用共沉淀测定法和等温滴定量热法对界面进行定量,以量化TPX2各个残基的能量贡献。已显示TPX2的残基Tyr8,Tyr10,Phe16和Trp34对于形成稳定的复合物至关重要,这表明可以通过阻断与这些残基互补的Aurora-A的三个口袋中的任何一个来消除相互作用。高亲和力结合也必须在Thr288上进行Aurora-A的磷酸化,在此我们确定了将Thr288磷酸化传递至TPX2结合位点的精氨酸残基。考虑到这些发现,我们对1255个针对Aurora-A的片段进行了基于X射线晶体学的高通量筛选,确定了59个命中位点。这些命中的四分之三以上都与上述口袋绑定在一起,既验证了我们对热点的识别,又证明了这种蛋白质与蛋白质相互作用的可药用性。我们的研究例证了诸如XChem之类的高通量晶体学设施在辅助药物发现方面的潜力。这些结果将加速Aurora-A / TPX2相互作用的化学抑制剂的开发。在这里,我们确定了将Thr288磷酸化传递至TPX2结合位点的精氨酸残基。考虑到这些发现,我们对1255个针对Aurora-A的片段进行了基于X射线晶体学的高通量筛选,确定了59个命中位点。这些命中的四分之三以上都与上述口袋绑定在一起,既验证了我们对热点的识别,又证明了这种蛋白质与蛋白质相互作用的可药用性。我们的研究例证了诸如XChem之类的高通量晶体学设施在辅助药物发现方面的潜力。这些结果将加速Aurora-A / TPX2相互作用的化学抑制剂的开发。在这里,我们确定了将Thr288磷酸化传递至TPX2结合位点的精氨酸残基。考虑到这些发现,我们对1255个针对Aurora-A的片段进行了基于X射线晶体学的高通量筛选,确定了59个命中位点。这些命中的四分之三以上都与上述口袋绑定在一起,既验证了我们对热点的识别,又证明了这种蛋白质与蛋白质相互作用的可药用性。我们的研究例证了诸如XChem之类的高通量晶体学设施在辅助药物发现方面的潜力。这些结果将加速Aurora-A / TPX2相互作用的化学抑制剂的开发。这些命中的四分之三以上都与上述口袋绑定在一起,既验证了我们对热点的识别,又证明了这种蛋白质与蛋白质相互作用的可药用性。我们的研究例证了诸如XChem之类的高通量晶体学设施在辅助药物发现方面的潜力。这些结果将加速Aurora-A / TPX2相互作用的化学抑制剂的开发。这些命中的四分之三以上都与上述口袋绑定在一起,既验证了我们对热点的识别,又证明了这种蛋白质与蛋白质相互作用的可药用性。我们的研究例证了诸如XChem之类的高通量晶体学设施在辅助药物发现方面的潜力。这些结果将加速Aurora-A / TPX2相互作用的化学抑制剂的开发。
更新日期:2017-10-31
中文翻译:

使用生化,生物物理和基于片段的方法表征Aurora-A / TPX2相互作用中的三个可药用热点
有丝分裂激酶的Aurora-A及其伙伴蛋白TPX2(Ť argeting P rotein为X enopus驱动蛋白样蛋白2)在癌症中过表达,并且有人提出它们可以作为致癌全酶共同发挥作用。TPX2负责在有丝分裂期间激活Aurora-A,确保适当的细胞分裂。因此,与TPX2的界面破坏是新型抗癌药物的潜在目标,这些新型抗癌药物利用了癌细胞对有丝分裂应激的增强敏感性。在这里,我们研究使用共沉淀测定法和等温滴定量热法对界面进行定量,以量化TPX2各个残基的能量贡献。已显示TPX2的残基Tyr8,Tyr10,Phe16和Trp34对于形成稳定的复合物至关重要,这表明可以通过阻断与这些残基互补的Aurora-A的三个口袋中的任何一个来消除相互作用。高亲和力结合也必须在Thr288上进行Aurora-A的磷酸化,在此我们确定了将Thr288磷酸化传递至TPX2结合位点的精氨酸残基。考虑到这些发现,我们对1255个针对Aurora-A的片段进行了基于X射线晶体学的高通量筛选,确定了59个命中位点。这些命中的四分之三以上都与上述口袋绑定在一起,既验证了我们对热点的识别,又证明了这种蛋白质与蛋白质相互作用的可药用性。我们的研究例证了诸如XChem之类的高通量晶体学设施在辅助药物发现方面的潜力。这些结果将加速Aurora-A / TPX2相互作用的化学抑制剂的开发。在这里,我们确定了将Thr288磷酸化传递至TPX2结合位点的精氨酸残基。考虑到这些发现,我们对1255个针对Aurora-A的片段进行了基于X射线晶体学的高通量筛选,确定了59个命中位点。这些命中的四分之三以上都与上述口袋绑定在一起,既验证了我们对热点的识别,又证明了这种蛋白质与蛋白质相互作用的可药用性。我们的研究例证了诸如XChem之类的高通量晶体学设施在辅助药物发现方面的潜力。这些结果将加速Aurora-A / TPX2相互作用的化学抑制剂的开发。在这里,我们确定了将Thr288磷酸化传递至TPX2结合位点的精氨酸残基。考虑到这些发现,我们对1255个针对Aurora-A的片段进行了基于X射线晶体学的高通量筛选,确定了59个命中位点。这些命中的四分之三以上都与上述口袋绑定在一起,既验证了我们对热点的识别,又证明了这种蛋白质与蛋白质相互作用的可药用性。我们的研究例证了诸如XChem之类的高通量晶体学设施在辅助药物发现方面的潜力。这些结果将加速Aurora-A / TPX2相互作用的化学抑制剂的开发。这些命中的四分之三以上都与上述口袋绑定在一起,既验证了我们对热点的识别,又证明了这种蛋白质与蛋白质相互作用的可药用性。我们的研究例证了诸如XChem之类的高通量晶体学设施在辅助药物发现方面的潜力。这些结果将加速Aurora-A / TPX2相互作用的化学抑制剂的开发。这些命中的四分之三以上都与上述口袋绑定在一起,既验证了我们对热点的识别,又证明了这种蛋白质与蛋白质相互作用的可药用性。我们的研究例证了诸如XChem之类的高通量晶体学设施在辅助药物发现方面的潜力。这些结果将加速Aurora-A / TPX2相互作用的化学抑制剂的开发。



























 京公网安备 11010802027423号
京公网安备 11010802027423号