Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Morphometric characterization of fibrinogen's αC regions and their role in fibrin self-assembly and molecular organization
Nanoscale ( IF 6.7 ) Pub Date : 2017-08-18 00:00:00 , DOI: 10.1039/c7nr04413e Anna D. Protopopova 1, 2, 3, 4 , Rustem I. Litvinov 1, 2, 3, 4, 5 , Dennis K. Galanakis 4, 6, 7 , Chandrasekaran Nagaswami 1, 2, 3, 4 , Nikolay A. Barinov 8, 9, 10 , Alexander R. Mukhitov 1, 2, 3, 4 , Dmitry V. Klinov 8, 9, 10 , John W. Weisel 1, 2, 3, 4
Nanoscale ( IF 6.7 ) Pub Date : 2017-08-18 00:00:00 , DOI: 10.1039/c7nr04413e Anna D. Protopopova 1, 2, 3, 4 , Rustem I. Litvinov 1, 2, 3, 4, 5 , Dennis K. Galanakis 4, 6, 7 , Chandrasekaran Nagaswami 1, 2, 3, 4 , Nikolay A. Barinov 8, 9, 10 , Alexander R. Mukhitov 1, 2, 3, 4 , Dmitry V. Klinov 8, 9, 10 , John W. Weisel 1, 2, 3, 4
Affiliation
|
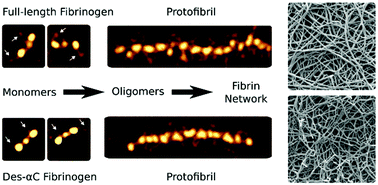
The flexible C-terminal parts of fibrinogen's Aα chains named the αC regions have been shown to play a role in fibrin self-assembly, although many aspects of their structure and functions remain unknown. To examine the involvement of the αC regions in the early stages of fibrin formation, we used high-resolution atomic force microscopy to image fibrinogen and oligomeric fibrin. Plasma-purified full-length human fibrinogen or des-αC fibrinogen lacking most of the αC regions, untreated or treated with thrombin, was imaged. Up to 80% of the potentially existing αC regions were visualized and quantified; they were highly heterogeneous in their length and configurations. Conversion of fibrinogen to fibrin was accompanied by an increase in the incidence and length of the αC regions as well as transitions from more compact conformations, such as a globule on a string, to extended and more flexible offshoots. Concurrent dynamic turbidimetry, confocal microscopy, and scanning electron microscopy revealed that trimming of the αC regions slowed down fibrin formation, which correlated with longer protofibrils, thinner fibers, and a denser network. No structural distinctions, except for the incidence of the αC regions, were revealed in the laterally aggregated protofibrils made of the full-length or des-αC fibrinogens, suggesting a pure kinetic effect of the αC regions on the fibrin architecture. This work provides a structural molecular basis for the promoting role of the αC regions in the early stages of fibrin self-assembly and reveals this stage of fibrin formation as a potential therapeutic target to modulate the structure and mechanical properties of blood clots.
中文翻译:

纤维蛋白原αC区的形态特征及其在纤维蛋白自组装和分子组织中的作用
纤维蛋白原Aα链的柔性C端部分称为αC区,已显示出在纤维蛋白自组装中的作用,尽管其结构和功能的许多方面仍然未知。为了检查αC区在纤维蛋白形成的早期阶段的参与,我们使用高分辨率原子力显微镜对纤维蛋白原和低聚纤维蛋白进行成像。对未经纯化或凝血酶处理的,缺少大部分αC区域的血浆纯化的全长人纤维蛋白原或des-αC纤维蛋白原成像。可视化和量化了多达80%的潜在存在的αC区域;它们的长度和配置高度不同。纤维蛋白原向纤维蛋白的转化伴随着αC区域的发生率和长度的增加,以及从更紧密构象的转变,例如字符串上的小球,以扩展和更灵活的分支。并发动态比浊法,共聚焦显微镜和扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块结构和机械性能的潜在治疗靶标。扩展和更灵活的分支。并发动态比浊法,共聚焦显微镜和扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。扩展和更灵活的分支。并发动态比浊法,共聚焦显微镜和扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。并发动态比浊法,共聚焦显微镜和扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块结构和机械性能的潜在治疗靶标。并发动态比浊法,共聚焦显微镜和扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。
更新日期:2017-09-21
中文翻译:

纤维蛋白原αC区的形态特征及其在纤维蛋白自组装和分子组织中的作用
纤维蛋白原Aα链的柔性C端部分称为αC区,已显示出在纤维蛋白自组装中的作用,尽管其结构和功能的许多方面仍然未知。为了检查αC区在纤维蛋白形成的早期阶段的参与,我们使用高分辨率原子力显微镜对纤维蛋白原和低聚纤维蛋白进行成像。对未经纯化或凝血酶处理的,缺少大部分αC区域的血浆纯化的全长人纤维蛋白原或des-αC纤维蛋白原成像。可视化和量化了多达80%的潜在存在的αC区域;它们的长度和配置高度不同。纤维蛋白原向纤维蛋白的转化伴随着αC区域的发生率和长度的增加,以及从更紧密构象的转变,例如字符串上的小球,以扩展和更灵活的分支。并发动态比浊法,共聚焦显微镜和扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块结构和机械性能的潜在治疗靶标。扩展和更灵活的分支。并发动态比浊法,共聚焦显微镜和扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。扩展和更灵活的分支。并发动态比浊法,共聚焦显微镜和扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。并发动态比浊法,共聚焦显微镜和扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块结构和机械性能的潜在治疗靶标。并发动态比浊法,共聚焦显微镜和扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。扫描电子显微镜显示,αC区域的修整减慢了纤维蛋白的形成,这与更长的原纤维,更细的纤维和更密的网络有关。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。在由全长或去α-C纤维蛋白原形成的侧向聚集的原纤维中,除了αC区域的发生率外,没有发现任何结构上的区别,这表明αC区域对血纤蛋白结构具有纯粹的动力学作用。这项工作为αC区在纤维蛋白自组装的早期阶段的促进作用提供了结构分子基础,并揭示了纤维蛋白形成的这一阶段作为调节血凝块的结构和机械性能的潜在治疗靶标。


























 京公网安备 11010802027423号
京公网安备 11010802027423号